
Natriumpermanganat (NaMnO4) egenskaber, risici
Det natriumpermanganat Det er en kemisk forbindelse med formlen NaMnO4. Den fås hovedsageligt i monohydratform. Dens struktur er vist i figur 1. Dette salt er hygroskopisk og har et lavt smeltepunkt..
Det har de samme egenskaber som kaliumpermanganat (KMnO4), skønt natriumpermanganat er ca. 15 gange mere opløseligt i vand. På trods af dette anvendes kaliumpermanganat mere almindeligt, da dets produktionsomkostninger er lavere..
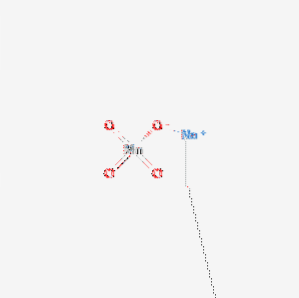
Natriumpermanganat opløses let i vand til dannelse af dybe lilla opløsninger, hvis fordampning giver lyse lilla-sorte prismatiske krystaller af NaMnO4 · H2O monohydrat. Kaliumsaltet danner ikke et hydrat. På grund af dets hygroskopiske natur er det mindre nyttigt i analytisk kemi end dets kaliummodstykke..
Det kan fremstilles ved omsætning af mangandioxid med natriumhypochlorit og natriumhydroxid eller natriumcarbonat som følger:
2MnOto + 3NaClO + 2NaOH → 2NaMnO4 + 3NaCl + HtoELLER
2MnOto + 3NaClO + NatoCO3 → 2NaMnO4 + 3NaCl + COto
Ved anvendelse af natriumcarbonat er udbyttet lavere, og reaktionen skal opvarmes for at opnå produktet (vapid, 2016).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber
Natriumpermanganat har et lignende udseende som kaliumpermanganat. De er prismatiske krystaller eller lilla kugler, der i vandig opløsning danner en farvet væske, der varierer fra lyserød til lilla afhængigt af koncentrationen. Dens udseende er vist i figur 2.

Den vandfrie form af forbindelsen har en molekylvægt og et smeltepunkt på henholdsvis 141,9254 g / mol og 36 ° C, og monohydratformen har en molekylvægt og et smeltepunkt på henholdsvis 159,94 g / mol og 170 ° C.
Densiteten er 1.972 g / ml, og den er meget opløselig i vand og er i stand til at opløse 900 g pr. Liter ved stuetemperatur (National Center for Biotechnology Information, 2017).
Reaktivitet og farer
Natriumpermanganat er ikke brændbart, men det fremskynder forbrændingen af brændbare materialer. Hvis det brændbare materiale er findelt, kan blandingen være eksplosiv..
Kan antændes spontant i kontakt med flydende brændbare materialer. Kontakt med svovlsyre kan forårsage brande eller eksplosioner..
Eddikesyre eller eddikesyreanhydrid kan eksplodere med permanganater, hvis de ikke holdes kolde. Eksplosioner kan forekomme, når permanganater, der er blevet behandlet med svovlsyre, kommer i kontakt med benzen, carbondisulfid, diethylether, ethylalkohol, råolie eller organisk materiale (SODIUM PERMANGANATE, 2016).
Disse stoffer fremskynder forbrændingen, når de er involveret i en brand. Nogle kan nedbrydes eksplosivt, når de opvarmes eller er involveret i en brand. Kan eksplodere fra varme eller forurening.
Nogle vil reagere eksplosivt med kulbrinter (brændstoffer). Det kan antænde brændstoffer (træ, papir, olie, tøj osv.). Beholdere kan eksplodere, når de opvarmes. Afstrømning kan skabe brand eller eksplosionsfare (SODIUM PERMANGANATE, S.F.).
Kaliumpermanganat reagerer med vand til dannelse af mangandioxid, kaliumhydroxid og ilt. Kaliumhydroxid er stærkt ætsende. I alvorlige tilfælde kan systemiske effekter, herunder intravaskulær koagulation, hepatitis, pancreatitis og svigt forekomme..
Kronisk indtagelse kan forårsage paræstesier, rysten på grund af mangantoksicitet. Mangan-neurotoksicitet er resultatet af udtømning af dopamin og neurotoksiner, dopaminquinon og peroxid (SODIUM PERMANGANATE, 2014).
Natriumpermanganat beskadiger øjenvæv ved kontakt og forårsager forbrændinger. Det kan være irriterende ved kontakt med huden og efterlade lilla pletter på den. I tilfælde af indånding kan det forårsage beskadigelse af luftvejene (sikkerhedsark for materialedata natriumpermanganat, S.F.).
Hvis forbindelsen kommer i kontakt med huden, skal den skylles med rigeligt vand i mindst 15 minutter, mens forurenet tøj og sko fjernes..
Ved indtagelse bør opkastning ikke induceres. Stramt tøj såsom en skjortekrave, bælte eller slips skal løsnes. Hvis offeret ikke trækker vejret, skal der gives mund-til-mund-genoplivning..
I tilfælde af indånding skal offeret fjernes fra eksponeringsstedet og flyttes til et køligt sted. Hvis det ikke trækker vejret, skal der gives kunstig åndedræt. Hvis vejrtrækningen er vanskelig, skal der gives ilt.
I alle tilfælde bør øjeblikkelig lægehjælp indhentes (Sikkerhedsdatablad Natriumpermanganatmonohydrat, 2013).
Ansøgninger
Sodiumpermanganat er ligesom kaliumforbindelsen et desinfektionsmiddel og bakteriedræbende antiseptisk middel. Dens anvendelser inkluderer blegningsharpikser, voks, fedt, halm, bomuld, silke og andre fibre og ruskind.
Det bruges også som et desinfektionsmiddel, deodorant, kemisk desinfektionsmiddel i fotografering og et reagens i syntetisk organisk kemi..
Ulovlige anvendelser har inkluderet produktionen af misbrugsmedicin og abort ved topisk påføring på vaginalvæggen. Historisk har permanganatopløsninger været anvendt som urinrørsvandende og skyllevæske til forgiftning..
Natriumpermanganat fungerer som et oxidationsmiddel i oxidationen af o-toluensulfonamid til dannelse af saccharin og oprensning af toluenamid. Det er også en modgift mod morfin og fosfor og syntetiske organiske / farmaceutiske reaktioner..
Natriumpermanganat er blevet brugt til vandbehandling og jordrehabilitering, fordi det er i stand til at nedbryde BTEX (benzen, toluen, ethylbenzen og xylen), phenoler, polycykliske aromatiske kulbrinter (PAH), chlorerede ethener og eksplosiver og fjerne hydrogensulfid.
På grund af den høje opløselighed i vand foretrækkes natriumpermanganat til applikationer, der kræver høje koncentrationer af permanganationer, såsom ætsning af plastdele på printkortet..
Andre anvendelser af natriumpermanganat inkluderer metaloverfladebehandlingsmiddel og metalrensningsformulering osv. (Sodium Permanganate Aqueous Solution (NaMnO4), S.F.).
Natriumpermanganat kan erstatte kaliumpermanganat i nogle anvendelser, da det er permanganationen, der er oxidationsmidlet..
Da natriumpermanganat eksisterer i monohydratform, kan det imidlertid ikke bruges til analytiske anvendelser såsom redoxtitreringer..
Referencer
- Materiale datasikkerhedsark natriumpermanganat. (S.F.). Hentet fra dogee.org: dogee.org.
- Sikkerhedsdatablad Natriumpermanganatmonohydrat. (2013, 21. maj). Hentet fra sciencelab: sciencelab.com.
- National Center for Biotechnology Information. (2017, 4. marts). PubChem Compound Database; CID = 23673458. Hentet fra PubChem: pubchem.ncbi.nlm.nih.gov.
- NATRIUMPERMANGANAT. (2014, 5. december). Hentet fra toxnet: toxnet.nlm.nih.gov.
- NATRIUM PERMANGANAT. (2016). Hentet fra cameochemicals: cameochemicals.noaa.gov.
- Vandig opløsning af natriumpermanganat (NaMnO4). (S.F.). Hentet fra changyuancorp: en.changyuancorp.com.
- NATRIUMPERMANGANAT. (S.F.). Hentet fra kemikaliebog: chemicalbook.com.
- (2016, 27. juni). Natriumpermanganat fra mangandioxid og natriumhypochlorit. Hentet fra chemistry.stackexchange: chemistry.stackexchange.com.


Endnu ingen kommentarer