
Natriumperoxid (Na2O2) struktur, egenskaber, anvendelser

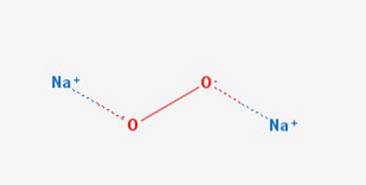
Det natriumperoxid er en kemisk forbindelse med formlen NatoELLERto Den har to ionbindinger mellem de to natriumatomer og O2-molekylet. Det findes i forskellige hydrater og peroxyhydrater inklusive NatoELLERto 2HtoELLERto 4HtoPå entoELLERto 2HtoPå entoELLERto 2HtoELLERto og NatoELLERto 8HtoELLER.
Den har en sekskantet krystallinsk struktur, men når den opvarmes, gennemgår denne form en overgang til en fase med ukendt symmetri ved 512 ° C. Dens krystallinske struktur er vist i figur 2 (Sodium: sodium peroxide, 1993-2016).

Natriumperoxid kan fremstilles i stor skala ved at reagere metallisk natrium med ilt ved 130-200 ° C (Ashford, 1994), en proces, der genererer natriumoxid, som i et separat trin absorberer ilt:
4 Na + Oto → NatoELLER
2 NatoO + Oto → 2 NatoELLERto
Den foreliggende batchproces involverer oxidation af natrium i natriummonoxid med tør luft og efterfølgende oxidation af monoxidet i peroxid med 90% oxygen..
I 1951 begyndte USI at drive den første kontinuerlige proces til produktion af natriumperoxid. Processen er unik i én henseende: den bruger luft i stedet for ren ilt.
Variationer af en batchproces er blevet brugt i næsten 70 år (SCHOW, 1957), for eksempel indeholder det kommercielle produkt mellem 90 og 95% hydrogenperoxid.
Artikelindeks
- 1 Fysiske og kemiske egenskaber af natriumperoxid
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber af natriumperoxid
Natriumperoxid er et gulligt, granulært fast stof, der bliver gul i kontakt med atmosfæren (National Center for Biotechnology Information, S.F.). Deres udseende er illustreret i figur 3.

Natriumperoxid har en molekylvægt på 77,98 g / mol og en densitet på 2,805 g / ml. Forbindelsen har et smeltepunkt på 460,00 ° C, hvor det begynder at nedbrydes til natriumoxid og molekylært ilt ifølge reaktionen:
2 Na2O2 → 2 Na2O + O2
Dens kogepunkt er 657 ° C (Royal Society of Chemistry, 2015).
Natriumperoxid reagerer voldsomt med reduktionsmidler, brændbare materialer og lette metaller. Reagerer eksotermt og hurtigt eller endda eksplosivt med vand til dannelse af en stærk base (NaOH) og ilt (O2).
En blanding med ammoniumpersulfat kan eksplodere, hvis den udsættes for friktion (formaling i mørtel), hvis den opvarmes, eller hvis en strøm af kuldioxidgas ledes over den..
Reagerer meget kraftigt med hydrogensulfidgas. Selv i fravær af luft kan reaktionen ledsages af en flamme. En eksplosion opstår, når kuldioxidgas ledes over en blanding af natriumperoxid og magnesiumpulver..
Blandinger med eddikesyre eller eddikesyreanhydrid kan eksplodere, hvis de ikke holdes kolde. De er spontant brandfarlige i kontakt med anilin, benzen, diethylether eller organiske materialer såsom papir og træ..
Blandes med trækul, glycerin, visse olier og fosfor brænder eller eksploderer. En blanding med calciumcarbid (pulver) kan sprænge i flammer, når den udsættes for fugtig luft og eksplodere, når den opvarmes.
Det nedbrydes ofte voldsomt i nærvær af katalytiske mængder mangandioxid. Blandingen med svovlmonochlorid fører til en voldsom reaktion. Det kan reagere og forårsage antændelse af brændstoffer (SODIUM PEROXIDE, 2016).
Reaktivitet og farer
Natriumperoxid er en forbindelse klassificeret som en stærk base, eksplosiv og stærk oxidationsmiddel baseret på dens reaktivitetsalarm. Blandinger med brændbart materiale antændes let ved friktion, varme eller kontakt med fugt.
Kan nedbrydes kraftigt ved længerevarende udsættelse for varme og forårsage brud på beholdere, der indeholder det.
Meget farlig i tilfælde af kontakt med hud og øjne (irriterende) og i tilfælde af indtagelse og indånding. Langvarig eksponering kan forårsage forbrændinger og sår på huden. Overeksponering ved indånding kan forårsage irritation af luftvejene..
Betændelse i øjet er kendetegnet ved rødme, vanding og kløe. Betændelse i huden er kendetegnet ved kløe, afskalning, rødme eller lejlighedsvis blærer.
I tilfælde af øjenkontakt skal du kontrollere, om du har kontaktlinser, og fjerne dem. Øjne skal skylles straks med rindende vand i mindst 15 minutter, så øjenlågene holdes åbne..
I tilfælde af hudkontakt vaskes den forurenede hud forsigtigt og forsigtigt med rindende vand og ikke-slibende sæbe. Koldt vand kan bruges. Irriteret hud skal dækkes med et blødgørende middel.
Hvis hudkontakten er svær, skal den vaskes med et desinfektionsmiddel og sæbe og dække den forurenede hud med en antibakteriel creme..
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område..
Evakuer offeret til et sikkert område så hurtigt som muligt. Løsn stramt tøj såsom en skjortekrave, bælte eller slips. Giv ilt, hvis vejrtrækningen er vanskelig. Hvis offeret ikke trækker vejret, skal du udføre genoplivning fra mund til mund.
I tilfælde af indtagelse bør opkastning ikke induceres. Hvis offeret ikke trækker vejret, skal du udføre genoplivning fra mund til mund.
I alle tilfælde skal du straks søge lægehjælp (Sikkerhedsdatablad Sodium peroxide, 2013).
Ansøgninger
Natriumperoxid bruges i tøjblegemidler, da det reagerer med vand for at producere hydrogenperoxid, et blegemiddel ifølge reaktionen:
NatoELLERto + 2 timertoO → 2 NaOH + HtoELLERto
Ud over hydrogenperoxid producerer reaktionen natriumhydroxid (lud), som holder opløsningen basisk. Varmt vand og en alkalisk opløsning er begge nødvendige for at hydrogenperoxid fungerer bedst som blegemiddel (Field, S.F.).
Natriumperoxid bruges til at blegge træmasse til produktion af papir og tekstiler. Det bruges i øjeblikket primært til specialiserede laboratorieoperationer, for eksempel mineralekstraktion. Derudover anvendes natriumperoxid som oxidationsmiddel i kemiske reaktioner..
Det bruges også som en iltkilde ved at reagere det med kuldioxid for at producere ilt og natriumcarbonat, derfor er det især nyttigt i dykkerudstyr, ubåde osv. (Brug af natriumperoxid til at skrubbe kuldioxidemissioner, 2014).
Referencer
- Ashford, R. (1994). Ashford's Dictionary of Industrial Chemicals. London: Publications Ltd.
- Field, S. (S.F.). Ingredienser -Natriumperoxid. Hentet fra sci-toys.com.
- Sikkerhedsdatablad Natriumperoxid. (2013, 21. maj). Hentet fra sciencelab.com.
- National Center for Biotechnology Information. (S.F.). PubChem Compound Database; CID = 14803. Hentet fra PubChem.
- Royal Society of Chemistry. (2015). Natriumperoxid. Hentet fra chemspider.com.
- SCHOW, H. R. (1957). Sodiumperoxid-produktionshistorien. Fremskridt inden for kemi, bind 19, 118-123.
- NATRIUMPEROXID. (2016). Hentet fra komokemikalier.
- Natrium: natriumperoxid. (1993-2016). Hentet fra webelementer.
- Brug af natriumperoxid til at skrubbe kuldioxidemissioner. (2014, 10. november). Hentet fra stackexchange.



Endnu ingen kommentarer