
Polaritet (kemi) polære molekyler og eksempler
Det kemisk polaritet det er en egenskab, der er karakteriseret ved tilstedeværelsen af en markant heterogen fordeling af elektrondensiteter i et molekyle. I dens struktur er der derfor negativt ladede regioner (δ-), og andre positivt ladede (δ +), der genererer et dipolmoment.
Bindingsdipolmomentet (µ) er en måde at udtrykke et molekyls polaritet på. Det er normalt repræsenteret som en vektor, hvis oprindelse er i ladningen (+) og dens ende er placeret i ladningen (-), selvom nogle kemikere repræsenterer det omvendt.
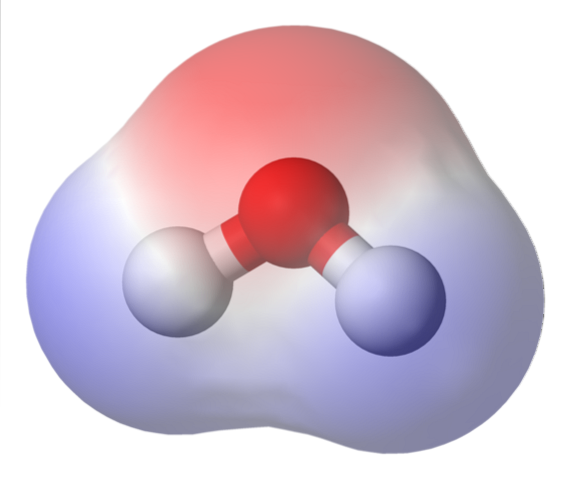
Det øverste billede viser det elektrostatiske potentialkort for vand, HtoO. Den rødlige region (iltatom) svarer til den med den højeste elektrondensitet, og det kan også ses, at den skiller sig ud over de blå regioner (hydrogenatomer).
Da fordelingen af denne elektrondensitet er heterogen, siges det, at der er en positiv og en negativ pol. Derfor tales der om kemisk 'polaritet' og dipolmoment.
Artikelindeks
- 1 Dipolmoment
- 1.1 Asymmetri i vandmolekylet
- 2 polære molekyler
- 3 eksempler
- 3.1 SO2
- 3,2 CHCI3
- 3.3 HF
- 3.4 NH3
- 3.5 Makromolekyler med heteroatomer
- 4 Referencer
Dipole øjeblik
Dipolmomentet µ er defineret ved følgende ligning:
µ = δd
Hvor δ er den elektriske ladning for hver pol, positiv (+ δ) eller negativ (-δ) og d er afstanden mellem dem.
Dipolmomentet udtrykkes normalt i afsked, repræsenteret af symbolet D. En coulomb · meter er lig med 2.998 · 1029 D.
Værdien af dipolmomentet for bindingen mellem to forskellige atomer er i forhold til forskellen i elektronegativiteter for de atomer, der danner bindingen..
For at et molekyle skal være polært, er det ikke nok at have polære bindinger i sin struktur, men det skal også have en asymmetrisk geometri; på en sådan måde, at det forhindrer dipolmomenterne i at fjerne hinandens vektorer.
Asymmetri i vandmolekylet
Vandmolekylet har to O-H-bindinger. Molekylets geometri er vinkelret, det vil sige i form af et "V"; så dipolmomenterne af bindingerne ikke annullerer hinanden, men derimod produceres summen af dem, der peger mod iltatomet.
Det elektrostatiske potentialkort for HtoEller reflektere dette.
Hvis kantmolekylet H-O-H observeres, kan følgende spørgsmål opstå: er det virkelig asymmetrisk? Hvis en imaginær akse trækkes gennem iltatomet, vil molekylet dele sig i to lige store halvdele: H-O | O-H.
Men det er ikke sådan, hvis den imaginære akse er vandret. Når denne akse nu deler molekylet igen i to halvdele, har vi oxygenatomet på den ene side og de to hydrogenatomer på den anden..
Af denne grund er den tilsyneladende symmetri af HtoEller det ophører med at eksistere og betragtes derfor som et asymmetrisk molekyle.
Polære molekyler
Polære molekyler skal opfylde en række egenskaber, såsom:
-Fordeling af elektriske ladninger i den molekylære struktur er asymmetrisk.
-De er normalt opløselige i vand. Dette skyldes, at polære molekyler kan interagere med dipol-dipolkræfter, hvor vand er karakteriseret ved at have et stort dipolmoment.
Derudover er dens dielektriske konstant meget høj (78,5), hvilket gør det muligt at holde de elektriske ladninger adskilt, hvilket øger dets opløselighed..
-Generelt har polære molekyler høje kogepunkter og smeltepunkter.
Disse kræfter udgøres af dipol-dipol-interaktion, London-spredningskræfter og dannelse af hydrogenbindinger..
-På grund af deres elektriske ladning kan polære molekyler lede elektricitet.
Eksempler
SWto
Svovldioxid (SOto). Ilt har en elektronegativitet på 3,44, mens svovlens elektronegativitet er 2,58. Derfor er ilt mere elektronegativt end svovl. Der er to S = O-bindinger, hvor O har en δ-ladning og S en δ-ladning+.
Fordi det er et vinkelmolekyle med S i toppunktet, er de to dipolmomenter orienteret i samme retning; og derfor tilføjes de, hvilket gør SO-molekyletto være polær.
CHCl3
Chloroform (HCCl3). Der er en C-H-binding og tre C-Cl-obligationer.
Elektronegativiteten af C er 2,55, og elektronegativiteten af H er 2,2. Således er kulstof mere elektronegativt end brint; og derfor vil dipolmomentet blive orienteret fra H (δ +) mod C (δ-): Cδ--Hδ+.
I tilfælde af C-Cl-obligationer har C en elektronegativitet på 2,55, mens Cl har en elektronegativitet på 3,16. Dipolvektoren eller dipolmomentet er orienteret fra C mod Cl i de tre C-bindinger δ+-Cl δ-.
Da der er en elektronfattig region omkring hydrogenatomet og en elektronrig region, der består af de tre kloratomer, CHCl3 betragtes som et polært molekyle.
HF
Hydrogenfluorid har kun en HF-binding. Elektronegativiteten af H er 2.22 og elektronegativiteten af F er 3.98. Derfor ender fluor med den højeste elektrondensitet, og bindingen mellem begge atomer beskrives bedst som: Hδ+-Fδ-.
NH3
Ammoniak (NH3) har tre NH-obligationer. Elektronegativiteten af N er 3,06 og elektronegativiteten af H er 2,22. I alle tre bindinger er elektrondensiteten orienteret mod kvælstof og er endnu højere på grund af tilstedeværelsen af et par frie elektroner.
NH-molekylet3 det er tetraedrisk, hvor N-atomet optager toppunktet. De tre dipolmomenter, der svarer til NH-bindingerne, er orienteret i samme retning. I dem er δ- placeret i N og δ + i H. Bindingerne er således: Nδ--Hδ+.
Disse dipolmomenter, molekylets asymmetri og det frie par elektroner på nitrogen gør ammoniak til et meget polært molekyle..
Makromolekyler med heteroatomer
Når molekylerne er meget store, er det ikke længere sikkert at klassificere dem som apolare eller polære selv. Dette skyldes, at der kan være dele af dens struktur med både apolære (hydrofobe) og polære (hydrofile) egenskaber..
Disse typer forbindelser er kendt som amfifile eller amfipatiske. Fordi den apolære del kan betragtes som elektronfattig i forhold til den polære del, er der en polaritet til stede i strukturen, og amfifile forbindelser betragtes som polære forbindelser..
Et makromolekyle med heteroatomer kan generelt forventes at have dipolmomenter og dermed kemisk polaritet..
Heteroatomer forstås som dem, der adskiller sig fra dem, der udgør strukturens skelet. For eksempel er kulstofskelettet biologisk det vigtigste af alle, og atomet, hvormed kulstof danner en binding (ud over hydrogen) kaldes et heteroatom..
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Prof. Krishnan. (2007). Polære og ikke-polære forbindelser. St. Louis Community College. Gendannet fra: users.stlcc.edu
- Murmson, Serm. (14. marts 2018). Sådan forklares polaritet. Videnskabelig. Gendannet fra: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (5. december 2018). Polar Bond Definition og eksempler (Polar Covalent Bond). Gendannet fra: thoughtco.com
- Wikipedia. (2019). Kemisk polaritet. Gendannet fra: en.wikipedia.org
- Quimitube. (2012). Kovalent binding: bindingspolaritet og molekylær polaritet. Gendannet fra: quimitube.com


Endnu ingen kommentarer