
Aufbau-principbegreb og forklaring, eksempler
Det Aufbau-princip Den består af en nyttig guide til teoretisk forudsigelse af den elektroniske konfiguration af et element. Ordet aufbau henviser til det tyske verbum "at bygge." Reglerne dikteret af dette princip er beregnet til at "hjælpe med at bygge atomet".
Når vi taler om den hypotetiske atomkonstruktion, refererer den udelukkende til elektroner, som igen går hånd i hånd med det stigende antal protoner. Protoner definerer atomnummeret Z for et kemisk element, og for hver tilsat til kernen tilføjes en elektron for at kompensere for denne stigning i positiv ladning..
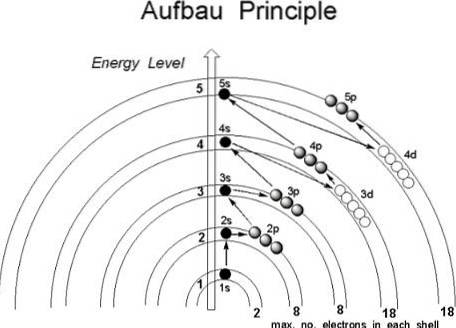
Selv om det ser ud til, at protonerne ikke følger en etableret rækkefølge for at slutte sig til atomkernen, følger elektronerne en række betingelser på en sådan måde, at de først besætter atomets regioner med lavere energi, specifikt dem, hvor sandsynligheden for at finde dem i rummet er større: orbitalerne.
Aufbau-princippet hjælper sammen med andre elektroniske udfyldningsregler (Pauli-udelukkelsesprincippet og Hunds regel) med at etablere den rækkefølge, som elektroner skal føjes til elektronskyen; på denne måde er det muligt at tildele en korrekt elektronisk konfiguration af et bestemt kemisk element.
Artikelindeks
- 1 Koncept og forklaring
- 1.1 Lag og underlag
- 1.2 Paulis udelukkelsesprincip og Hunds regel
- 2 Eksempler
- 2.1 Kulstof
- 2.2 Oxygen
- 2.3 Calcium
- 3 Begrænsninger i Aufbau-princippet
- 4 Referencer
Koncept og forklaring
Hvis atomet blev betragtet som om det var en løg, ville der findes et endeligt antal lag indeni det, bestemt af det primære kvantetal n.
Yderligere indeni dem er subshells, hvis former afhænger af kvantetalene azimuthal l og magnetisk m.
Orbitalerne identificeres af de første tre kvantetal, mens det fjerde, spin s, ender med at indikere, i hvilken orbitale elektronen vil være placeret. Det er så i disse områder af atomet, hvor elektronerne roterer, fra det inderste til det yderste lag: valenslaget, det mest energiske af alle..
Dette er tilfældet, i hvilken rækkefølge skal elektronerne udfylde orbitalerne? I henhold til Aufbau-princippet skal de tildeles baseret på den stigende værdi (n + l).
Ligeledes skal elektronerne inden i subshells (n + l) besætte subshell med den laveste energiværdi; med andre ord optager de den laveste værdi af n.
Efter disse konstruktionsregler udviklede Madelung en visuel metode, der består i at tegne diagonale pile, som hjælper med at opbygge den elektroniske konfiguration af et atom. På nogle uddannelsesmæssige områder er denne metode også kendt som regnmetoden..
Lag og underlag
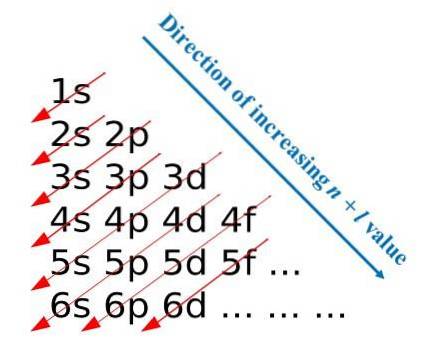
Det første billede illustrerer en grafisk metode til opnåelse af elektronkonfigurationer, mens det andet billede er den respektive Madelung-metode. De mest energiske lag er placeret øverst, og de mindst energiske er i en nedadgående retning..
Fra venstre mod højre "underlagene", p, d og f af deres tilsvarende hovedenerginiveauer "transiteres". Hvordan beregnes værdien af (n + l) for hvert trin markeret med de diagonale pile? For eksempel for 1s orbital er denne beregning lig med (1 + 0 = 1), for 2s orbital (2 + 0 = 2) og for 3p orbital (3 + 1 = 4).
Resultatet af disse beregninger stammer fra billedets konstruktion. Derfor, hvis det ikke er tilgængeligt ved hånden, skal du blot bestemme (n + l) for hver orbital og begynde at fylde orbitalerne med elektroner fra den med den laveste værdi på (n + l) til den med den maksimale værdi.
Brug af Madelung-metoden letter imidlertid konstruktionen af elektronkonfigurationen meget og gør det til en underholdende aktivitet for dem, der lærer det periodiske system..
Paulis udelukkelsesprincip og Hunds regel
Madelung-metoden angiver ikke subshells orbitaler. Under hensyntagen til dem siger Pauli-udelukkelsesprincippet, at ingen elektron kan have de samme kvantetal som en anden; eller hvad er det samme, et par elektroner kan ikke have både positive eller negative spins.
Dette betyder, at deres spin-kvantetal s ikke kan være ens, og derfor skal deres spins parres, når de besætter den samme orbitale.
På den anden side skal fyldningen af orbitalerne ske på en sådan måde, at de er degenereret i energi (Hunds regel). Dette opnås ved at holde alle elektroner i orbitalerne uparret, indtil det er strengt nødvendigt at parre et par af disse (som med ilt).
Eksempler
De følgende eksempler opsummerer hele konceptet med Aufbau-princippet..
Kulstof
For at bestemme dets elektroniske konfiguration skal atomnummeret Z først være kendt og dermed antallet af elektroner. Kulstof har Z = 6, så dets 6 elektroner skal placeres i orbitalerne ved hjælp af Madelung-metoden:

Pilene svarer til elektronerne. Efter at have udfyldt 1s og 2s orbitaler, hver med to elektroner, tildeles 2p orbitaler ved forskel de resterende to elektroner. Hunds regel manifesteres således: to degenererede orbitaler og en tom.
Ilt

Oxygen har Z = 8, så det har to ekstra elektroner i modsætning til kulstof. En af disse elektroner skal placeres i den tomme 2p orbital, og den anden skal parres for at danne det første par med pilen pegende nedad. Derfor manifesteres Pauli-udelukkelsesprincippet her.
Kalk
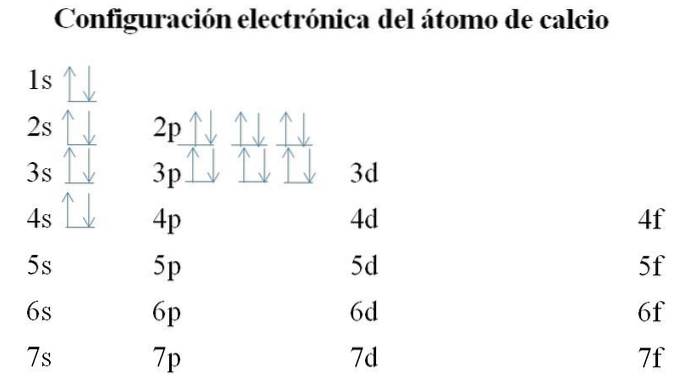
Calcium har 20 elektroner, og orbitalerne er stadig fyldt med den samme metode. Fyldningsrækkefølgen er som følger: 1s-2s-2p-3s-3p-4s.
Det kan bemærkes, at i stedet for først at udfylde 3d-orbitalen besætter elektronerne 4'erne. Dette sker, inden der gøres plads til overgangsmetaller, grundstoffer, der fylder det indre lag 3d.
Begrænsninger i Aufbau-princippet
Aufbau's princip undlader at forudsige de elektroniske konfigurationer af mange overgangsmetaller og sjældne jordarter (lanthanider og actinider).
Dette skyldes, at de energiske forskelle mellem ns og (n-1) d orbitaler er lave. Af grunde, der understøttes af kvantemekanik, kan elektroner foretrække at degenerere (n-1) d-orbitalerne på bekostning af at fortryde eller løsne elektroner fra ns-orbitalen.
Et berømt eksempel er tilfældet med kobber. Dens elektronkonfiguration forudsagt af Aufbau-princippet er 1sto2sto2 s63sto3p64sto3d9, når det eksperimentelt har vist sig at være 1sto2sto2 s63sto3p64s13d10.
I den første er en enslig elektron parret i en 3d orbital, mens i den anden er alle elektroner i de 3d orbitaler parret..
Referencer
- Helmenstine, Anne Marie, Ph.D. (15. juni 2017). Aufbau Princip Definition. Hentet fra: thoughtco.com
- Prof. N. De Leon. (2001). Aufbau-princippet. Hentet fra: iun.edu
- Kemi 301. Aufbau-princip. Hentet fra: ch301.cm.utexas.edu
- Hozefa Arsiwala og teacherlookup.com. (1. juni 2017). Dybtgående: Aufbau-princip med eksempler. Hentet fra: teacherlookup.com
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 199-203.
- Goodphy. (27. juli 2016). Ordning for Madelung. [Figur]. Hentet fra: commons.wikimedia.org



Endnu ingen kommentarer