
Isochoriske procesformler og beregning, hverdagseksempler

EN isokorisk proces Det er alle termodynamiske processer, hvor lydstyrken forbliver konstant. Disse processer kaldes ofte også isometrisk eller isovolumetrisk. Generelt kan en termodynamisk proces forekomme ved konstant tryk og kaldes derfor isobarisk.
Når det sker ved konstant temperatur, siges det i så fald at være en isoterm proces. Hvis der ikke er nogen varmeudveksling mellem systemet og miljøet, kaldes det adiabatisk. På den anden side kaldes den genererede proces isochorisk, når der er et konstant volumen.
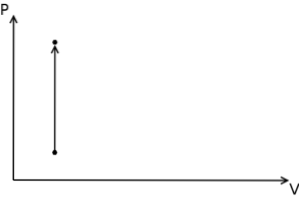
I tilfælde af den isokoriske proces kan det siges, at trykvolumenarbejdet i disse processer er nul, da dette skyldes multiplicering af trykket med stigningen i volumen.
Desuden er de isokoriske processer i et termodynamisk tryk-volumen-diagram repræsenteret i form af en lodret lige linje..
Artikelindeks
- 1 Formler og beregning
- 1.1 Det første princip for termodynamik
- 2 Eksempler på hverdag
- 2.1 Den ideelle Otto-cyklus
- 3 Praktiske eksempler
- 3.1 Første eksempel
- 3.2 Andet eksempel
- 4 Referencer
Formler og beregning
Det første princip for termodynamik
I termodynamik beregnes arbejde ud fra følgende udtryk:
W = P ∙ ∆ V
I dette udtryk W er arbejdet målt i Joule, P trykket målt i Newton pr. Kvadratmeter, og ∆ V er ændringen eller stigningen i volumen målt i kubikmeter..
Ligeledes fastslår det såkaldte første princip for termodynamik, at:
∆ U = Q - W
I denne formel er W det arbejde, der udføres af systemet eller på systemet, Q er varmen, der modtages eller udsendes af systemet, og ∆ U er systemets interne energivariation. Ved denne lejlighed måles de tre størrelser i Joule.
Da arbejdet i en isokorisk proces er nul, viser det sig at:
∆ U = QV (siden, ∆ V = 0, og derfor W = 0)
Med andre ord skyldes variationen i systemets interne energi udelukkende varmeudvekslingen mellem systemet og miljøet. I dette tilfælde kaldes den overførte varme konstant volumenvarme..
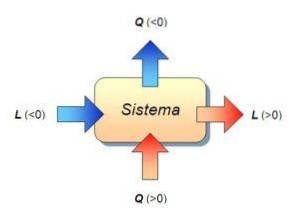
Varmekapaciteten i et legeme eller system skyldes at dele mængden af energi i form af varme, der overføres til et legeme eller et system i en given proces, og den temperaturændring, som det oplever..
Når processen udføres ved konstant volumen, taler vi om varmekapacitet ved konstant volumen, og den betegnes med Cv (molær varmekapacitet).
Det vil blive opfyldt i så fald:
Spørgsmålv = n ∙ Cv ∙ ∆T
I denne situation er n antallet af mol, Cv er den førnævnte molære varmekapacitet ved konstant volumen, og ∆T er den temperaturstigning, som kroppen eller systemet oplever.
Eksempler på hverdagen
Det er let at forestille sig en isokorisk proces, det er kun nødvendigt at tænke på en proces, der finder sted ved konstant volumen; det vil sige, hvor beholderen, der indeholder materialet eller materialesystemet, ikke ændrer volumen.
Et eksempel kan være tilfældet med en (ideel) gas lukket i en lukket beholder, hvis volumen ikke kan ændres på nogen måde, hvortil der tilføres varme. Antag, at der er tale om en gas indeholdt i en flaske.
Ved at overføre varme til gassen, som allerede forklaret, vil den ende med at resultere i en stigning eller stigning i dens interne energi.
Den omvendte proces ville være den af en gas, der er lukket i en beholder, hvis volumen ikke kan ændres. Hvis gassen afkøles og giver miljøet varme, ville gasens tryk blive reduceret, og værdien af den interne energi i gassen ville falde.
Den ideelle Otto-cyklus
Otto-cyklussen er et ideelt tilfælde af den cyklus, der benyttes af benzinmaskiner. Den oprindelige anvendelse var dog i maskiner, der brugte naturgas eller andre typer brændstoffer i gasform..
Under alle omstændigheder er Ottos ideelle cyklus et interessant eksempel på en isokorisk proces. Det sker, når forbrændingen af benzin-luftblandingen finder sted øjeblikkeligt i en forbrændingsbil.
I dette tilfælde er der en stigning i temperaturen og trykket på gassen inde i cylinderen, idet volumen forbliver konstant..
Praktiske eksempler
Første eksempel
Angivet en (ideel) gas indesluttet i en cylinder udstyret med et stempel, skal du angive, om følgende tilfælde er eksempler på isokoriske processer.
- Der arbejdes 500 J på gassen.
I dette tilfælde ville det ikke være en isokorisk proces, for at udføre arbejde på gassen er det nødvendigt at komprimere den og derfor ændre dens volumen.
- Gassen udvides ved at flytte stemplet vandret.
Igen ville det ikke være en isokorisk proces, da udvidelsen af gassen indebærer en ændring i dens volumen.
- Cylinderstemplet er fastgjort, så det ikke kan bevæge sig, og gassen afkøles.
Denne gang ville det være en isokorisk proces, da der ikke ville være nogen volumenvariation.
Andet eksempel
Bestem variationen i intern energi, som en gas indeholdt i en beholder med et volumen på 10 L, der udsættes for 1 atm tryk, vil opleve, hvis dens temperatur stiger fra 34 ºC til 60 ºC i en isokorisk proces, kendt som dens molære specifikke varme. Cv = 2,5R (værende R = 8,31 J / mol K).
Da det er en konstant volumenproces, vil den interne energivariation kun forekomme som en konsekvens af varmen, der tilføres gassen. Dette bestemmes med følgende formel:
Spørgsmålv = n ∙ Cv ∙ ∆T
For at beregne den leverede varme er det først nødvendigt at beregne de mol gas, der er indeholdt i beholderen. Til dette er det nødvendigt at ty til den ideelle gasligning:
P ∙ V = n ∙ R ∙ T
I denne ligning er n antallet af mol, R er en konstant, hvis værdi er 8,31 J / molK, T er temperaturen, P er det tryk, som gassen udsættes for målt i atmosfærer og T er temperaturen målt i Kelvin.
Løs for n og opnå:
n = R ∙ T / (P ∙ V) = 0,39 mol
Så det:
∆ U = QV = n ∙ Cv ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J
Referencer
- Resnik, Halliday & Krane (2002). Fysik bind 1. Cecsa.
- Laider, Keith, J. (1993). Oxford University Press, red. Verden for fysisk kemi.
- Varmekapacitet. (nd). I Wikipedia. Hentet den 28. marts 2018 fra en.wikipedia.org.
- Latent Heat. (nd). I Wikipedia. Hentet den 28. marts 2018 fra en.wikipedia.org.
- Isokorisk proces. (nd). I Wikipedia. Hentet den 28. marts 2018 fra en.wikipedia.org.

Endnu ingen kommentarer