
Periodiske egenskaber af elementer og deres egenskaber

Det Elementernes periodiske egenskaber er dem, der definerer deres fysiske og kemiske adfærd fra et atomperspektiv, og hvis størrelser ud over atomnummeret tillader en klassificering af atomer.
Af alle egenskaberne er disse karakteriseret, som deres navn indikerer, for at være periodiske; det vil sige, hvis det periodiske system undersøges, vil det være muligt at certificere, at dets størrelser overholder en tendens, der falder sammen og gentages med rækkefølgen af elementerne i perioder (rækker) og grupper (kolonner).

For eksempel, hvis en periode krydses, og en periodisk egenskab falder i størrelse med hvert element, vil det samme ske med det i alle perioder. På den anden side, hvis nedgang i en gruppe eller kolonne øger dens størrelse, kan det samme forventes at ske for de andre grupper..
Og så gentages dens variationer og viser en simpel tendens, der stemmer overens med rækkefølgen af elementerne efter deres atomnummer. Disse egenskaber er direkte ansvarlige for elementernes metalliske eller ikke-metalliske karakter samt deres reaktiviteter, hvilket har hjulpet med at klassificere dem i større dybde..
Hvis elementernes identitet et øjeblik var ukendt, og de blev betragtet som mærkelige "kugler", kunne det periodiske system genopbygges (med meget arbejde) ved hjælp af disse egenskaber.
På denne måde ville de formodede kugler erhverve farver, der gør det muligt at differentiere dem fra hinanden i grupper (øverste billede). At kende deres elektroniske egenskaber kunne de organiseres i perioder, og grupperne afslørede dem, der har det samme antal valenselektroner.
At lære og ræsonnere om periodiske egenskaber er det samme som at vide, hvorfor elementer reagerer på en eller anden måde; er at vide, hvorfor metalliske elementer er i visse områder af tabellen, og ikke-metalliske elementer i en anden.
Artikelindeks
- 1 Hvad er de periodiske egenskaber og deres egenskaber
- 1.1 -Atomisk radius
- 1.2 -Elektronegativitet
- 1,3 -Metal karakter
- 1.4 -Ioniseringsenergi
- 1.5 -Elektronisk affinitet
- 2 Referencer
Hvad er de periodiske egenskaber og deres egenskaber
-Atomic radio
Når man observerer kuglerne i billedet, er det første, der kan bemærkes, at de ikke alle har samme størrelse. Nogle er større end andre. Hvis du ser nærmere på, vil du opdage, at disse størrelser varierer efter et mønster: i en periode falder det fra venstre til højre, og i en gruppe stiger det fra top til bund..
Ovenstående kan også siges på denne måde: Atomradien falder mod grupperne eller kolonnerne til højre og øges i de nedre perioder eller rækker. Dette er tilfældet, atomerradius er den første periodiske egenskab, da dens variationer følger et mønster inden for elementerne..
Atomladning vs elektroner
Hvorfor dette mønster? I en periode optager atomets elektroner det samme energiniveau, hvilket er relateret til afstanden, der adskiller dem fra kernen. Når vi bevæger os fra en gruppe til en anden (hvilket er det samme som at gå gennem perioden til højre), tilføjer kernen både elektroner og protoner inden for det samme energiniveau..
Derfor kan elektronerne ikke optage yderligere afstande fra kernen, hvilket øger dens positive ladning, fordi den har flere protoner. Derfor oplever elektronerne en større tiltrækningskraft mod kernen og tiltrækker dem mere og mere, når antallet af protoner stiger..
Derfor har elementerne yderst til højre i det periodiske system (gule og turkise søjler) de mindste atomare radier..
På den anden side, når du "hopper" fra en periode til en anden (hvilket er det samme som at sige, at du går ned en gruppe), tillader de nye energiniveauer, at elektronerne kan optage mere fjerne rum fra kernen. At være længere væk tiltrækker kernen (med flere protoner) dem med mindre kraft; og atomare radier stiger derfor.
Ioniske radier
Ioniske radier følger et lignende mønster som atomare radier; Disse afhænger dog ikke så meget af kernen, men af hvor mange eller færre elektroner atomet har i forhold til dets neutrale tilstand.
Kationerne (Na+, ACto+, Til3+, Væreto+, Tro3+) udviser en positiv ladning, fordi de har mistet en eller flere elektroner, og derfor tiltrækker kernen dem med større kraft, da der er færre frastød mellem dem. Resultatet: kationer er mindre end de atomer, hvorfra de stammer.
Og for anionerne (Oto-, F-, Sto-, jeg-tværtimod udviser de negativ ladning, fordi de har en eller flere elektroner i overskud, hvilket øger deres frastødninger til hinanden over den tiltrækning, som kernen udøver. Resultatet: anionerne er større end de atomer, hvorfra de stammer (billede nedenfor).
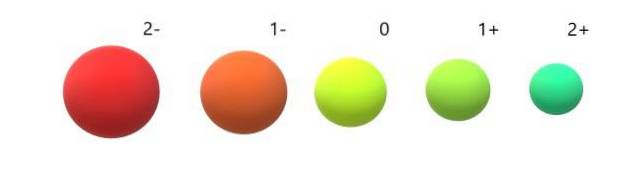
Det forstås, at 2- anionen er den mest voluminøse af alle, og 2+ kationen den mindste. Radierne stiger, når atomet er negativt ladet og trækker sig sammen, når det er positivt ladet..
-Elektronegativitet
Når grundstoffer har små atomradier, tiltrækkes ikke kun deres elektroner meget stærkt, men også elektroner fra nærliggende atomer, når de danner en kemisk binding. Denne tendens til at tiltrække elektroner fra andre atomer i en forbindelse er kendt som elektronegativitet..
Bare fordi et atom er lille, betyder det ikke, at det vil være mere elektronegativt. I så fald ville elementerne helium og brint være de mest elektronegative atomer. Helium, så vidt videnskaben har vist, danner ikke nogen kovalent binding af nogen art; og hydrogen, har bare en enkelt proton i kernen.
Når atomradierne er store, har kernerne ikke nok kraft til at tiltrække elektroner fra andre atomer; derfor er de mest elektronegative elementer dem med en lille atomradius og et større antal protoner.
Igen er de, der perfekt opfylder disse karakteristika, de ikke-metalliske elementer i p-blok i det periodiske system; Disse er dem, der hører til gruppe 16 eller ilt (O, S, Se, Te, Po) og gruppe 17 eller fluor (F, Cl, Br, I, At).
Trend
Ifølge alt, hvad der er blevet sagt, er de mest elektronegative elementer især placeret i det øverste højre hjørne af det periodiske system; med fluor som det element, der leder listen over de mest elektronegative.
Hvorfor? Uden at ty til elektronegativitetsskalaer (Pauling, Mulliken osv.), Selvom fluor er større end neon (den ædle gas fra sin periode), kan førstnævnte danne bindinger, mens sidstnævnte ikke kan. Derudover har dens kerne mange protoner på grund af dens lille størrelse, og hvor fluor er, vil der være et dipolmoment.
-Metallisk karakter
Hvis et element har en atomradius sammenlignet med dem i samme periode og heller ikke er meget elektronegativ, så er det et metal og har en høj metallisk karakter.
Hvis vi går tilbage til hovedbilledet, svarer de rødlige og grønlige kugler, ligesom de grålige, til metalliske elementer. Metaller har unikke egenskaber, og herfra begynder de periodiske egenskaber at flette sammen med materiens fysiske og makroskopiske egenskaber..
Elementer med en høj metallisk karakter er kendetegnet ved deres relativt store atomer, nemme at miste elektroner, da kernerne næppe kan tiltrække dem til dem..
Som et resultat oxideres de let eller mister elektroner til dannelse af kationer, M+; dette betyder ikke, at alle kationer er metalliske.
Trend
På dette tidspunkt kan du forudsige, hvordan den metalliske karakter varierer i det periodiske system. Hvis det vides, at metaller har store metalliske radier, og at de også er få elektronegative, bør det forventes, at de tungeste grundstoffer (de nedre perioder) er de mest metalliske; og de letteste elementer (de øvre perioder), jo mindre metalliske.
Også den metalliske karakter falder jo mere elektronegativt elementet bliver. Dette betyder, at de gennem de perioder og grupper til højre for det periodiske system i deres øvre perioder finder de mindre metalliske elementer..
Derfor stiger den metalliske karakter nedad gennem en gruppe og falder fra venstre til højre i samme periode. Blandt de metalelementer, vi har: Na (natrium), Li (lithium), Mg (magnesium), Ba (barium), Ag (sølv), Au (guld), Po (polonium), Pb (bly), Cd (cadmium ), Al (aluminium) osv.
-Ioniseringsenergi
Hvis et atom har en stor atomradius, kan det forventes, at dets kerne ikke vil holde elektroner i de yderste skaller fanget med betydelig kraft. Derfor vil det ikke kræve meget energi at fjerne dem fra atomet i gasfasen (individualiseret); dvs. ioniseringsenergien, EI, der er nødvendig for at fjerne en elektron fra dem.
EI svarer også til at sige, at det er energien, der skal tilføres for at overvinde den attraktive kraft af kernen i et atom eller en gasformig ion på dets yderste elektron. Jo mindre atom og jo mere elektronegativ, jo lavere er dets EI; dette er din tendens.
Følgende ligning illustrerer et eksempel:
Na (g) => Na+(g) + e-
Den EI, der er nødvendig for at opnå dette, er ikke så stor sammenlignet med den anden ionisering:
Na+(g) => Nato+(g) + e-
Siden i Na+ positive ladninger dominerer, og ionen er mindre end det neutrale atom. Derfor er kernen af Na+ tiltrækker elektroner med en meget større kraft, der kræver en meget større EI.
-Elektronisk tilknytning
Og endelig er der den periodiske egenskab ved elektronisk affinitet. Dette er atomets energiske tendens i gasfasen til at acceptere en elektron. Hvis atomet er lille og har en kerne med en stor tiltrækningskraft, vil det være let for det at acceptere elektronen og danne en stabil anion..
Jo mere stabil anionen er i forhold til dens neutrale atom, jo større er dens elektronaffinitet. Imidlertid kommer frastød mellem elektronerne selv også i spil.
Kvælstof har for eksempel en højere elektronaffinitet end ilt. Dette skyldes, at dets tre 2p-elektroner ikke er parret og afviser hinanden og den indgående elektron mindre; mens der er ilt, er der et par parrede elektroner, der udøver større elektronisk frastødning; og i fluor er der to par.
Det er af denne grund, at tendensen i elektroniske tilhørsforhold siges at normalisere sig fra den tredje periode i det periodiske system..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Prof. Ortega Graciela M. (1. april 2014). Elementernes periodiske egenskaber. Farve abc. Gendannet fra: abc.com.py
- Kemi LibreTexts. (7. juni 2017). Elementernes periodiske egenskaber. Gendannet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (2. januar 2019). Elementernes periodiske egenskaber. Gendannet fra: thoughtco.com
- Toppr. (s.f.). Periodiske egenskaber af elementer. Gendannet fra: toppr.com /
- Elementernes periodiske egenskaber: En rejse over bordet er en rejse gennem kemi. [PDF]. Gendannet fra: cod.edu

Endnu ingen kommentarer