
Katalasetest begrundelse, teknik og anvendelser
Det katalasetest er en metode, der anvendes i bakteriologilaboratorier for at afsløre tilstedeværelsen af katalaseenzymet i de bakterier, der besidder det. Sammen med Gram-pletten er de de vigtigste tests, der skal udføres på nyisolerede mikroorganismer. Disse tests vejleder mikrobiologen om de trin, der skal følges for den endelige identifikation af den pågældende mikroorganisme..
Generelt har bakterier, der indeholder cytochrom, enzymkatalasen, hvilket betyder, at fakultative aerobe og anaerobe bakterier skal have den. Der er dog undtagelser, såsom Streptococcus, som til trods for at være fakultative anaerobe mikroorganismer ikke har enzymkatalase.
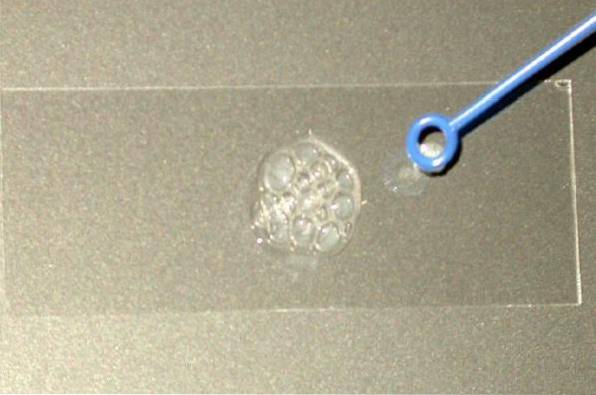
Derfor bruges katalasetesten primært til at skelne mellem Staphylococaceae- og Micrococaceae-familierne (begge katalase-positive) og Streptococaceae-familien (katalase-negative)..
Ligeledes adskiller slægten Bacillus (katalase-positiv) sig fra slægten Clostridium (katalase-negativ), blandt andre.
Artikelindeks
- 1 begrundelse
- 2 Rutinemæssig teknik til katalasetest
- 2.1 -Slide-metode
- 2.2-Direkte metode i ren kultur
- 2.3 -Metode med kapillarrør eller Fung og Petrishko
- 2.4 -Taylor- og Achanzar-metode til katalasetest, der giver tvivlsomt
- 3 Catalasetest for Mycobacterium-arter
- 3.1 -Materialer
- 3.2 -Forberedelse af reagenser
- 3.3 -Procedure
- 4 Brug
- 5 Kvalitetskontrol
- 6 Begrænsninger
- 7 Referencer
Basis
Catalase er et enzym klassificeret som hydroperoxidase, det betyder, at de bruger hydrogenperoxid (HtoELLERto).
Det betragtes også som en oxidoreduktase, da der i reaktionen, hvor den deltager, er et element, der tjener som en elektrondonor (reducerende stof) og en anden som en elektronreceptor (oxiderende stof).
Catalase er et protein, der indeholder en proseregruppe med fire trivalente jernatomer (Fe+++), derfor er det et homoprotein. Jern-ionen forbliver oxideret under reaktionen.
Det kan siges, at katalase er et afgiftende enzym, da dets funktion er at eliminere stoffer, der produceres under bakteriel metabolisme, der er giftige for bakterier. Blandt disse stoffer er hydrogenperoxid.
Hydrogenperoxid dannes ved nedbrydning af sukker aerobt. Denne proces sker som følger:
Superoxidionen (Oto-(fri radikal) dannes som slutproduktet ved assimilering af glucose ad den aerobe vej. Dette er giftigt og elimineres af enzymet superoxiddismutase, der omdanner det til gasformigt ilt og hydrogenperoxid.
Hydrogenperoxid er også giftigt for bakterier og skal fjernes. Enzymkatalasen nedbryder hydrogenperoxid til vand og ilt.
Catalase kan virke på andre substrater end hydrogenperoxid, såsom alkoholer, aldehyder, syrer, aromatiske aminer og phenoler. Imidlertid kan hydrogenperoxid også anvendes ved katalase til at oxidere andre toksiske forbindelser, såsom methyl og ethylalkohol..
Ligeledes er katalase til stede i fagocytiske celler og beskytter den mod den toksiske virkning af hydrogenperoxid..
Rutinemæssig teknik til katalasetest
-Slide-metode
Materialer
3% hydrogenperoxid (10 volumener).
Mikroskoprutschebane
Engangs plasthåndtag eller tandstikker af træ.
Behandle
Tag en tilstrækkelig mængde af kolonien til at studere uden at røre ved agaren, hvorfra den kom. Kolonien skal være frisk, det vil sige fra en kultur på 18 til 24 timer.
Placer kolonien på det tørre dias, og tilsæt en dråbe på 3% hydrogenperoxid (du kan også bruge HtoELLERto 30%). Overhold straks, om der frigøres bobler eller ej.
Fortolkning
Positiv reaktion: udvikling af gas, hvilket fremgår af dannelsen af bobler (stærk bobling).
Negativ reaktion: ingen bobledannelse.
-Direkte metode i ren kultur
Anbring 1 ml H.toELLERto 3% på en ren plade eller kilekultur, der ikke indeholder blod (helst næringsagar). Overhold om der er bobledannelse med det samme. Du kan også bruge HtoELLERto 30%.
Det fortolkes det samme som porta-objektmetoden.
-Kapillarrør eller Fung og Petrishko metode
Fyld et 67 mm kapillarrør til en højde på 20 mm med 3% hydrogenperoxid efter kapillaritet.
Berør den isolerede koloni, der skal undersøges, med kapillæren fuld af H.toELLERto ved 3%. Vær opmærksom på, om kapillærerne fyldes med bobler på cirka 10 sekunder. Denne metode tillader halvkvantificering af reaktionen i kryds:
Ingen kryds, ingen bobler (negativ reaktion).
+ --Få bobler (svag eller forsinket reaktion).
++ -Rigelige bobler (moderat reaktion).
+++ -Bobler når den modsatte ekstreme (energisk reaktion).
-Taylor og Achanzar metode til tvivlsomme katalasetest
Placer en isoleret koloni på et rent, tørt dias, og placer derefter en dråbe H.toELLERto 0,5% og dæk med et dækglas. Overhold, om der er dannelse af fangede bobler.
Fortolkning: tilstedeværelsen af bobler indikerer en positiv reaktion. Ingen bobler, det fortolkes som en negativ reaktion.
Catalasetest for Mycobacterium-arter
Denne teknik skal udføres ved at kontrollere pH og temperatur. Det skal udføres under en laminær strømningshætte, da manipulationen af de forskellige Mycobacterium-arter er farlig.
-Materialer
Hydrogenperoxid 30% eller 110 volumener (superoxal).
Phosphatbuffer pH 7
10% Tween 80
Mycobacterium kilekultur i 3 til 4 uger
-Forberedelse fra reagenser
Phosphatbuffer pH 7
Veje:
1,361 g (KHtoPO4vandfrit monokaliumphosphat.
1.420 g vandfrit dinatrium (Na2HPO3) phosphat.
Opløs begge salte i lidt sterilt destilleret vand og fyld op til 1000 ml med vand.
10% Tween 80
Foretag en 1:10 fortynding til Tween 80, der er kommercielt koncentreret, for at gøre dette skal du gøre som følger:
Tag 1 ml Tween 80, og anbring den i lidt destilleret vand, opløs og fyld derefter volumen op med vand op til 10 ml.
Endelig reagens
Bland en mængde fosfatbuffer med en mængde på 10% Tween 80 (i lige store dele). Definer i laboratoriet, hvor meget du vil forberede.
-Behandle
Anbring 5 ml fosfatbuffer i et sterilt reagensglas med skruelåg (bakelit).
Med en inokulationssløjfe skal du tage nok koloni af en Mycobacterium-vækst podet i kiler og opløses i fosfatbufferen.
Hæt røret uden at stramme tråden for hårdt. Anbringes i et vandbad ved 68 ° C i 20 til 30 minutter. Fjern og afkøles til 22-25 ° C
Mål 0,5 ml af det sidste reagens (bland) og tilsæt det til røret med den kolde opløsning. Overhold dannelsen af eller ikke bobler.
Det fortolkes det samme som de tidligere teknikker.
Brug
Når der opnås kolonivækst i berigede medier, skal der udføres en Gram-plet og en katalasetest på de opnåede kolonier. Dette vil vejlede mikrobiologen om de procedurer, der skal følges for endelig identifikation..

QA
For at evaluere den gode ydeevne af hydrogenperoxidreagenset skal du bruge frisk dyrkede kontrolstammer, såsom Staphylococcus aureus som en positiv kontrol og stammer af Streptococcus sp som negativ kontrol.
Et andet alternativ, der fungerer som en positiv kontrol, er at placere en dråbe hydrogenperoxid på blodagaren, erytrocytterne har katalase, derfor vil der være en bobling, hvis reagenset er i god stand.
En chokoladeagar kan bruges som en negativ kontrol, her erytrocytterne allerede lyseret, og testen er negativ.
Begrænsninger
-Brug ikke gamle kulturer til testen, da dette kan føre til falske negativer.
-Undgå at tage kolonier fra blodagarkulturer, hvis du er forsigtig med ikke at røre ved agaren; denne procedure kan føre til falske positive, da erythrocytter indeholder katalase.
-Hvis du tager platin-løkke-cologne, skal du ikke vende procedurens rækkefølge, da dette kan føre til falske positive. Dette skyldes, at platin er i stand til at reagere med hydrogenperoxid og forårsage en bobling..
-Brug ikke hydrogenperoxidreagenset, hvis det er meget gammelt, da reagenset er meget ustabilt og har tendens til at bryde sammen over tid..
-Opbevar hydrogenperoxidreagenset beskyttet mod lys og nedkølet for at undgå skader..
-Udfør en kvalitetskontrol af hydrogenperoxidreagenset, hver gang det bruges.
-Tag i betragtning, at hvis HtoELLERto ved 30% er reaktionerne stærkere end de, der udføres med HtoELLERto ved 3%.
Referencer
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. udgave Redaktionel Panamericana S.A. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12. udgave Redaktionel Panamericana S.A. Argentina.
- Mac Faddin J. (2003). Biokemiske tests til identifikation af bakterier af klinisk betydning. 3. udgave Redaktionel Panamericana. Buenos Aires. Argentina.
- BD Laboratories. Catalase-Gotario-reagens. Tilgængelig på: http://winklerltda.cl
- Vadequímica Laboratories. Peroxid. Ækvivalens mellem volumener og procent. Tilgængelig på: vadequimica.com


Endnu ingen kommentarer