
Hvad er emissionsspektret? (Med eksempler)

Det emissionsspektrum er spektret af bølgelængder af lys, der udsendes af atomer og molekyler, når der foretages en overgang mellem to energitilstande. Hvidt lys eller synligt lys, der rammer et prisme, nedbrydes i forskellige farver med specifikke bølgelængder for hver farve. Det opnåede farvemønster er det synlige strålingsspektrum af lys kaldet emissionsspektret.
Atomer, molekyler og stoffer har også et emissionsspektrum på grund af udsendelse af lys, når de absorberer den passende mængde energi udefra til transit mellem to energitilstande. Ved at føre dette lys gennem et prisme nedbrydes det i spektralfarvede linjer med forskellige bølgelængder for hvert element..
Vigtigheden af emissionsspektret er, at det gør det muligt at bestemme sammensætningen af ukendte stoffer og astronomiske objekter gennem analyse af deres spektrale linjer ved hjælp af emissionsspektroskopiteknikker..
Dernæst forklares det, hvad emissionsspektret består af, og hvordan det fortolkes, nogle eksempler nævnes, og de forskelle, der findes mellem emissions- og absorptionsspektret.
Artikelindeks
- 1 Hvad er et emissionsspektrum?
- 2 Fortolkning af emissionsspektret
- 3 Forskel mellem emissionsspektrum og absorptionsspektrum.
- 4 Eksempler på emissionsspektre af kemiske grundstoffer
- 5 Referencer
Hvad er et emissionsspektrum?
Atomer i et element eller et stof har elektroner og protoner, der holdes sammen takket være den elektromagnetiske tiltrækningskraft. Ifølge Bohr-modellen er elektronerne arrangeret på en sådan måde, at atomets energi er den lavest mulige. Dette energi energiniveau kaldes atomets grundtilstand..
Når atomerne erhverver energi udefra, bevæger elektronerne sig mod et højere energiniveau, og atomet ændrer sin jordtilstand til en ophidset tilstand..
I den ophidsede tilstand er elektronens opholdstid meget lille (≈ 10-8 s) (1), atomet er ustabilt og vender tilbage til jordtilstanden og passerer om nødvendigt gennem mellemliggende energiniveauer.
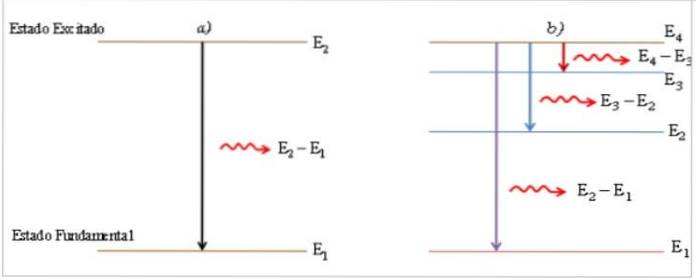
I overgangsprocessen fra en ophidset tilstand til en jordtilstand udsender atomet en lysfoton med energi lig med energiforskellen mellem de to tilstande, der er direkte proportional med frekvensen v og omvendt proportional med dens bølgelængde λ.
Den udsendte foton er vist som en lys linje, kaldet den spektrale linje (2), og den spektrale energifordeling af samlingen af udsendte fotoner ved atomets overgange er emissionsspektret.
Fortolkning af emissionsspektret
Nogle af atomets overgange er forårsaget af en temperaturforøgelse eller af tilstedeværelsen af andre eksterne energikilder, såsom en lysstråle, en strøm af elektroner eller en kemisk reaktion..
Hvis en gas såsom brint placeres i et kammer ved lavt tryk, og en elektrisk strøm føres gennem kammeret, udsender gassen et lys med sin egen farve, der adskiller det fra andre gasser..
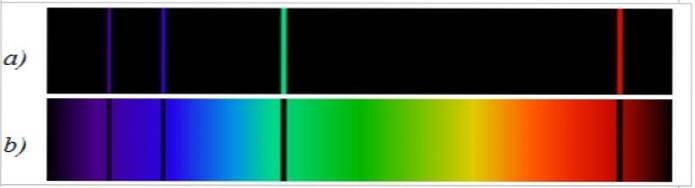
Ved at føre det udsendte lys gennem et prisme, i stedet for at opnå en regnbue af lys, opnås diskrete enheder i form af farvede linjer med specifikke bølgelængder, der bærer diskrete mængder energi.
Emissionsspektrumslinjerne er unikke i hvert element, og deres anvendelse fra spektroskopiteknikken tillader bestemmelse af den grundlæggende sammensætning af et ukendt stof såvel som sammensætningen af astronomiske objekter ved at analysere bølgelængderne på de udsendte fotoner under atomets overgang..
Forskel mellem emissionsspektrum og absorptionsspektrum.
I processerne med absorption og emission har atomet overgange mellem to energitilstande, men det er i absorption, at det vinder energi udefra og når tilstanden af excitation..
Den spektrale emissionslinje er modsat det kontinuerte spektrum af hvidt lys. I den første observeres den spektrale fordeling i form af lyse linjer, og i den anden observeres et kontinuerligt farvebånd..
Hvis en stråle af hvidt lys rammer en gas såsom brint, lukket i et kammer ved lavt tryk, vil kun en del af lyset blive absorberet af gassen, og resten vil blive transmitteret.
Når det transmitterede lys passerer gennem et prisme, bryder det ned i spektrale linjer, hver med en forskellig bølgelængde, der danner absorptionsspektret for gassen..
Absorptionsspektret er helt modsat emissionsspektret, og det er også specifikt for hvert element. Når man sammenligner begge spektre af det samme element, observeres det, at emissionsspektrallinjerne er de, der mangler i absorptionsspektret (figur 2).
Eksempler på emissionsspektre af kemiske grundstoffer
a) Brintatomets spektrale linjer i det synlige område af spektret er en rød linje på 656,3 nm, en lyseblå på 486,1 nm, en mørkeblå på 434 nm og en meget svag violet på 410 nm. Disse bølgelængder opnås fra ligningen Balmer - Rydberg i sin moderne version (3).
er bølge nummeret på den spektrale linje
er Rydbergs konstant (109666,56 cm-1)
er det højeste energiniveau
er det højeste energiniveau

b) Emissionsspektret af helium har to serier af hovedlinjer, den ene i det synlige område og den anden nær ultraviolet. Peterson (4) brugte Bohr-modellen til at beregne en række heliumemissionslinjer i den synlige del af spektret som et resultat af flere samtidige overgange af to elektroner til n = 5-tilstanden og opnåede værdier af den bølgelængde, der var konsistent med eksperimentelle resultater. De opnåede bølgelængder er 468,8 nm, 450,1 nm, 426,3 nm, 418,4 nm, 412,2 nm, 371,9 nm.
c) Emissionsspektret af natrium har to meget lyse linjer på 589 nm og 589,6 nm kaldet D-linjer (5). De andre linjer er meget svagere end disse, og af praktiske formål anses alt natriumlys for at komme fra D-linjerne..
Referencer
- Måling af levetider for ophidsede tilstande i hydrogenatomet. V. A. Ankudinov, S. V. Bobashev og E. P. Andreev. 1, 1965, Soviet Physics JETP, bind 21, s. 26-32.
- Demtröder, W. Laser Spectroscopy 1. Kaiserslautern: Springer, 2014.
- D.K. Rai, S.N Thakur og. Atom, laser og spektroskopi. New Delhi: Phi Learning, 2010.
- Bohr Revisited: Model og spektrale linjer af helium. Peterson, C. 5, 2016, Journal of young investigators, bind 30, s. 32-35.
- Tidsskrift for kemisk uddannelse. J.R. Appling, F. J. Yonke, R. A. Edgington og S. Jacobs. 3, 1993, bind 70, s. 250-251.



Endnu ingen kommentarer