
Hvad er molalitet? (med eksempler)
Det molalitet, betegnet med små bogstaver m, er det et udtryk, der bruges til at beskrive koncentrationen af en opløsning. Det kan defineres som antallet af mol opløst stof opløst i 1 kg opløsningsmiddel.
Det er lig med mol opløst stof (stoffet, der opløses) divideret med kilo opløsningsmiddel (det stof, der bruges til at opløse).
Hvor mol opløst stof er angivet ved ligningen:
Så i sidste ende er molalitetsligningen

Artikelindeks
- 1 Kendetegn ved molalitet
- 2 Forskelle og ligheder mellem molalitet (m) og molaritet (M)
- 3 Eksempler på molalitet
- 3.1 Eksempel 1:
- 3.2 Eksempel 2:
- 3.3 Eksempel 3:
- 4 Referencer
Kendetegn ved molalitet
Molalitet er et mål for koncentrationen af et opløst stof i en opløsning. Anvendes primært når temperaturen er en bekymring.

Molalitet er ikke så almindelig som dets modstykke, molaritet (mol opløst stof pr. Liter opløsningsmiddel), men det bruges i meget specifikke beregninger, især med hensyn til kolligative egenskaber (kogepunktshøjde, kogepunktsnedtrykning) af frysning)..
Da volumen er udsat for variation på grund af temperatur og tryk, varierer molariteten også alt efter temperatur og tryk. I nogle tilfælde er brugen af vægt en fordel, fordi massen ikke varierer med miljøforholdene..
Det er vigtigt, at massen af opløsningsmiddel bruges og ikke massen af opløsningen. Opløsninger mærket med molkoncentration er angivet med små bogstaver m. En 1,0 m opløsning indeholder 1 mol opløst stof pr. Kg opløsningsmiddel.
Fremstillingen af en opløsning af en given molalitet er let, fordi den kun kræver en god skala. Både opløsningsmiddel og opløst stof blandes snarere end målt på volumen.
SI (International System) -enheden for molalitet er mol / kg eller mol opløst stof pr. Kg opløsningsmiddel. En opløsning med en molalitet på 1 mol / kg beskrives ofte som "1 molal" eller "1 m".
I henhold til SI-enhedssystemet anser National Institute of Standards and Technology, som er den amerikanske myndighed for måling, udtrykket "molal" og enhedsymbolet "m" for at være forældet og foreslår at bruge mol / kg.
Forskelle og ligheder mellem molalitet (m) og molaritet (M)
Fremstillingen af en opløsning af en given molalitet involverer afvejning af både det opløste stof og opløsningsmidlet og opnåelse af deres masser..
Men i tilfælde af molaritet måles volumenet af opløsningen, hvilket giver plads til tæthedsvariationer som følge af temperaturen og trykets miljømæssige tilstand..
Dette betyder, at det er fordelagtigt at arbejde med molaliteten, der beskæftiger sig med massen, fordi massen af et kendt rent stof i den kemiske sammensætning er vigtigere end dets volumen, da volumenerne kan ændres under påvirkning af temperatur og tryk, mens masse forbliver uændret.
Desuden finder kemiske reaktioner sted i forhold til masse, ikke volumen. For at være baseret på masse kan molalitet let konverteres til et masseforhold eller en massefraktion.
For vandige opløsninger (opløsninger, hvor vand er opløsningsmidlet) nær stuetemperatur, er forskellen mellem molære og molære opløsninger ubetydelig..
Dette skyldes, at vand ved stuetemperatur har en densitet på 1 kg / L. Dette betyder, at "pr. L" af molaritet er lig med "pr. Kg" af molalitet..
For et opløsningsmiddel såsom ethanol, hvor massefylden er 0,789 kg / l, ville en 1 M opløsning være 0,789 m.
Den vigtige del af at huske forskellen er:
Molaritet - M → mol pr. Liter opløsning.
Molalitet - m → mol pr. Kg opløsningsmiddel.
Eksempler på molalitet
Eksempel 1:
Problem: Hvad er molaliteten af en opløsning indeholdende 0,086 mol NaCl opløst i 25,0 g vand?
Svar: Dette eksempel bruger den direkte molalitetsligning:
Mol opløst stof (NaCl) = 0,086 mol
Masse (vand) = 25,0 g = 25,0 x 10-3 kg
Udskiftning har vi:
Eksempel 2:
Problem: Hvad er molaliteten af en opløsning, hvis 124,2 gram NaOH opløses i 1,00 liter vand? (Vandtætheden er lig med 1,00 g / ml).
Svar: Vand kaldes det universelle opløsningsmiddel, og densiteten angives normalt som 1,00 gram pr. Milliliter, eller hvad er det samme som 1 kg pr. Liter. Dette gør det let at konvertere fra liter til kg..
I dette problem skal 124,2 gram NaOH omdannes til mol (for mol opløst stof) og en liter vand skal omdannes til kg (pr. Kg opløsningsmiddel) ved hjælp af densiteten.
Find først molmassen af NaOH:
OM EFTERMIDDAGENNa= 22,99 g / mol
OM EFTERMIDDAGENELLER= 16 g / mol
OM EFTERMIDDAGENH= 1 g / mol
OM EFTERMIDDAGENNaOH= 22,99 g / mol +16 g / mol +1 g / mol = 39,99 g / mol
For det andet omdanner du gram NaOH til mol ved hjælp af molmassen:
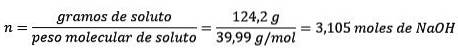
For det tredje skal du konvertere liter vand til kg ved hjælp af densiteten.
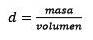
Løsning for massen er tilbage
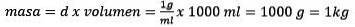
Endelig er molalitetsligningen løst:
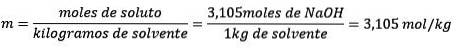
Eksempel 3:
Problem: Hvad er massen af vand i en vandig opløsning indeholdende 0,52 gram bariumchlorid (BaClto, PM = 208,23 g / mol), hvis koncentration er 0,005 mol / kg?
Svar: i dette tilfælde anvendes molkoncentrationen til at bestemme mængden af vand i opløsning.
For det første opnås antallet af mol BaClto i løsningen:
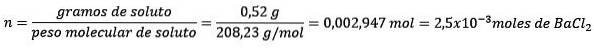
For det andet skal du fjerne kg opløsningsmiddel fra molalitetsligningen og løse for.
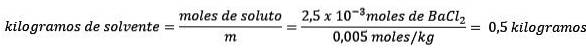
Referencer
- Videnskabelige noter og projekter. (2015, 22. februar). Beregning af molalitetseksempel Problem. Gendannet fra sciencenotes.org.
- Bhardwaj, M. (2014, 26. november). Hvad er et eksempel på molalitet? Gendannet fra socratic.org.
- (S.F.). Molalitet. Gendannet fra boundless.com.
- Helmenstine, T. (2017, 19. februar). Hvad er forskellen mellem molaritet og molalitet? Gendannet fra thoughtco.com.
- Molalitetsformel. (S.F.). Gendannet fra softschools.com.
- Molalitet. (S.F.). Gendannet fra chemteam.l
- Hvad er molalitet? (S.F.). Gendannet fra freechemistryonline.com.



Endnu ingen kommentarer