
Hvad er en isoterm proces? (Eksempler, øvelser)
Det isoterm proces eller isotermisk er en reversibel termodynamisk proces, hvor temperaturen forbliver konstant. I en gas er der situationer, hvor en ændring i systemet ikke frembringer variationer i temperatur, men i fysiske egenskaber..
Disse ændringer er faseændringerne, når stoffet skifter fra fast til væske, fra væske til gas eller omvendt. I sådanne tilfælde justerer stoffets molekyler deres position, tilføjer eller ekstraherer termisk energi..

Den termiske energi, der kræves for at en faseændring skal forekomme i et stof, kaldes latent varme eller transformationsvarme.
En måde at fremstille en proces på isoterm er at sætte det stof, der vil være systemet under undersøgelse, i kontakt med et eksternt termisk reservoir, hvilket er et andet system med en høj kalorieevne. På denne måde opstår en så langsom varmeudveksling, at temperaturen forbliver konstant..
Denne type proces forekommer ofte i naturen. For eksempel føler vi os syge hos mennesker, når kropstemperaturen stiger eller falder, for i vores krop finder mange kemiske reaktioner, der opretholder livet sted, sted ved en konstant temperatur. Dette gælder generelt for varmblodede dyr..
Andre eksempler er is, der smelter i varmen, når foråret kommer, og isterninger, der afkøler drikken..
Artikelindeks
- 1 Eksempler på isotermiske processer
- 1.1 Carnot-cyklussen
- 2 Beregning af arbejdet i en isoterm proces
- 2.1 - Øvelse 1
- 2.2 - Øvelse 2
- 3 Referencer
Eksempler på isotermiske processer
-Metabolismen af varmblodede dyr finder sted ved en konstant temperatur.

-Når vandet koger, sker der en faseændring fra væske til gas, og temperaturen forbliver konstant på ca. 100 ºC, da andre faktorer kan påvirke værdien.
-Smeltning af is er en anden almindelig isoterm proces, som det er at placere vand i fryseren for at fremstille isterninger..
-Automotorer, køleskabe såvel som mange andre typer maskiner fungerer korrekt i et bestemt temperaturområde. Enheder kaldet termostater. Forskellige driftsprincipper anvendes i dens design.
Carnot-cyklussen
En Carnot-motor er en ideel maskine, hvorfra man opnår arbejde takket være helt reversible processer. Det er en ideel maskine, fordi den ikke overvejer processer, der spreder energi, såsom viskositeten af det stof, der udfører arbejdet, eller friktion.
Carnot-cyklussen består af fire faser, hvoraf to er nøjagtigt isotermiske, og de to andre er adiabatiske. Isotermiske stadier er kompression og udvidelse af en gas, der er ansvarlig for at producere nyttigt arbejde.
En bilmotor fungerer på lignende principper. Bevægelsen af et stempel inde i cylinderen overføres til andre dele af bilen og producerer bevægelse. Det har ikke opførsel af et ideelt system som Carnot-motoren, men termodynamiske principper er almindelige.
Beregning af arbejdet i en isoterm proces
For at beregne det arbejde, der udføres af et system, når temperaturen er konstant, skal man bruge termodynamikens første lov, der siger:
ΔU = Q - W
Dette er en anden måde at udtrykke energibesparelsen i systemet på, præsenteret igennem ΔU eller ændring i energi, Spørgsmål som den leverede varme og til sidst W, hvad er det arbejde, der er udført af det nævnte system.
Antag, at det pågældende system er en ideel gas indeholdt i cylinderen i et bevægeligt stempel TIL, som fungerer, når dens volumen V ændring af V1 til Vto.

Den ideelle gasligning af tilstanden er PV = nRT, som relaterer volumen til tryk P og temperaturen T. Værdierne af n og R er konstante: n er antallet af mol af gassen og R konstanten af gasserne. I tilfælde af en isoterm proces er produktet PV det er konstant.
Nå, det udførte arbejde beregnes ved at integrere et lille differentieret arbejde, hvor en kraft F producerer en lille offset dx:
dW = Fdx = PAdx
Hvad Adx er den nøjagtige variation af lydstyrken dV, derefter:
dW = PdV
For at opnå det samlede arbejde i en isoterm proces integrerer vi udtrykket for dW:
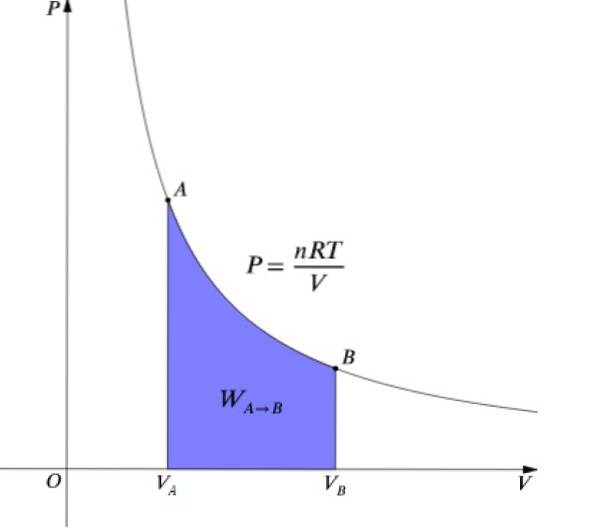
Presset P og lydstyrken V er tegnet i et diagram P-V som vist i figuren, og det udførte arbejde er lig med arealet under kurven:

Hvad ΔU = 0 Da temperaturen forbliver konstant, skal man i en isoterm proces:
Q = W
- Øvelse 1
En cylinder udstyret med et bevægeligt stempel indeholder en ideel gas ved 127 ºC. Hvis stemplet bevæger sig for at reducere det oprindelige volumen 10 gange, mens temperaturen holdes konstant, skal du finde antallet af mol gas indeholdt i cylinderen, hvis arbejdet på gassen er 38.180 J.
Faktum: R = 8,3 J / mol. K
Opløsning
Erklæringen siger, at temperaturen forbliver konstant, derfor er vi i nærværelse af en isoterm proces. For det arbejde, der er udført på gassen, har vi den tidligere udledte ligning:

127 º C = 127 + 273 K = 400 K
Løs for n, antallet af mol:
n = W / RT ln (V2 / V1) = -38 180 J / 8,3 J / mol. K x 400 K x ln (Vto/ 10Vto) = 5 mol
Arbejdet blev forud for et negativt tegn. Den opmærksomme læser vil have bemærket i det foregående afsnit, at W blev defineret som "arbejde udført af systemet" og har et + -tegn. Så "arbejdet udført på systemet" har et negativt tegn.
- Øvelse 2
Du har luft i en cylinder udstyret med et stempel. Oprindeligt er der 0,4 m3 gas under tryk 100 kPa og 80ºC temperatur. Luft komprimeres til 0,1 m3 sikre, at temperaturen inde i cylinderen forbliver konstant under processen.
Bestem, hvor meget arbejde der udføres under denne proces.
Opløsning
Vi bruger ligningen til tidligere afledt arbejde, men antallet af mol er ukendt, hvilket kan beregnes med den ideelle gasligning:
80 º C = 80 + 273 K = 353 K.
P1V1 = n.R.T → n = P1V1 / RT = 100000 Pa x 0,4 m3 /8,3 J / mol. K x 353 K = 13,65 mol
W = n.R.T ln (Vto/ V1) = 13,65 mol x 8,3 J / mol. K x 353 K x ln (0,1 /0,4) = -55,442,26 J
Igen indikerer det negative tegn, at der blev udført arbejde på systemet, hvilket altid sker, når gassen komprimeres.
Referencer
- Bauer, W. 2011. Fysik til ingeniørvidenskab. Bind 1. Mc Graw Hill.
- Cengel, Y. 2012. Termodynamik. 7mor Udgave. Mcgraw bakke.
- Figueroa, D. (2005). Serie: Fysik til videnskab og teknik. Volumen 4. Væsker og termodynamik. Redigeret af Douglas Figueroa (USB).
- Knight, R. 2017. Fysik for forskere og teknik: en strategi tilgang.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage læring.
- Wikipedia. Isoterm proces. Gendannet fra: en.wikipedia.org.

Endnu ingen kommentarer