
Hvad er vandige løsninger? (Med eksempler)
Det vandige opløsninger er de løsninger, der bruger vand til at nedbryde et stof. For eksempel mudder eller sukkervand. Når en kemisk art er opløst i vand, betegnes dette ved at skrive (aq) efter det kemiske navn.
Hydrofile (vandelskende) stoffer og mange ioniske forbindelser opløses eller dissocieres i vand. For eksempel, når bordsalt eller natriumchlorid opløses i vand, adskilles det i dets ioner for at danne Na + (aq) og Cl- (aq).

Hydrofobe (vandfrygtige) stoffer opløses generelt ikke i vand eller danner vandige opløsninger. For eksempel fører blanding af olie og vand ikke til opløsning eller dissociation.
Mange organiske forbindelser er hydrofobe. Ikke-elektrolytter kan opløses i vand, men de adskiller sig ikke i ioner og opretholder deres integritet som molekyler. Eksempler på ikke-elektrolytter inkluderer sukker, glycerol, urinstof og methylsulfonylmethan (MSM).
Egenskaber ved vandige opløsninger
Vandige løsninger leder ofte elektricitet. Opløsninger, der indeholder stærke elektrolytter, har tendens til at være gode elektriske ledere (fx havvand), mens opløsninger, der indeholder svage elektrolytter, har tendens til at være dårlige ledere (f.eks. Ledningsvand).
Årsagen er, at stærke elektrolytter adskiller sig fuldstændigt i ioner i vand, mens svage elektrolytter adskiller sig ufuldstændigt..
Når kemiske reaktioner mellem arter forekommer i en vandig opløsning, er reaktionerne normalt dobbelt fortrængningsreaktioner (også kaldet metatese eller dobbelt substitution)..
I denne type reaktion indtager kationen i det ene reagens kationens plads i det andet reagens og danner typisk en ionbinding. En anden måde at tænke på det er, at reaktive ioner "skifter partner".
Reaktioner i vandig opløsning kan producere produkter, der er opløselige i vand eller kan producere et bundfald..
Et bundfald er en forbindelse med lav opløselighed, der ofte falder ud af opløsningen som et fast stof..
Udtrykkene syre, base og pH gælder kun for vandige opløsninger. For eksempel kan du måle pH i citronsaft eller eddike (to vandige opløsninger), og de er svage syrer, men du kan ikke få nogen meningsfuld information fra testen af vegetabilsk olie med pH-papir..
Hvorfor opløses nogle faste stoffer i vand?
Det sukker, vi bruger til at forsøde kaffe eller te, er et molekylært fast stof, hvor individuelle molekyler holdes sammen af relativt svage intermolekylære kræfter..
Når sukker opløses i vand, brydes de svage bindinger mellem individuelle saccharosemolekyler, og disse C12H22O11-molekyler frigives i opløsning..
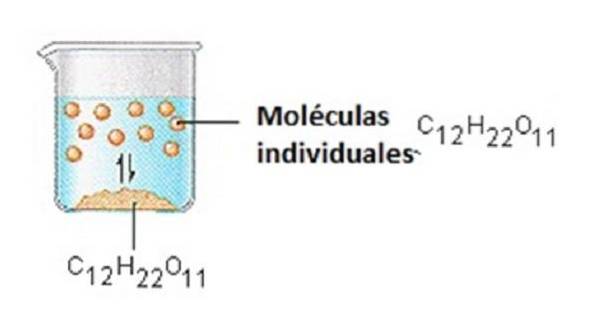
Det tager energi at bryde bindingerne mellem C12H22O11-molekylerne i saccharose. Det tager også energi at bryde hydrogenbindingerne i vand, som skal brydes for at indsætte et af disse saccharosemolekyler i opløsning..
Sukker opløses i vand, fordi energi frigives, når svagt polære saccharosemolekyler danner intermolekylære bindinger med polære vandmolekyler..
De svage bindinger, der dannes mellem det opløste stof og opløsningsmidlet, kompenserer for den energi, der kræves for at ændre strukturen af både det rene opløste stof og opløsningsmidlet..
I tilfælde af sukker og vand fungerer denne proces så godt, at op til 1800 gram saccharose kan opløses i en liter vand..
Ioniske faste stoffer (eller salte) indeholder positive og negative ioner, som holdes sammen takket være den store tiltrækningskraft mellem partikler med modsatte ladninger.
Når en af disse faste stoffer opløses i vand, frigives ionerne, der udgør det faste stof, i opløsning, hvor de forbinder sig med de polære opløsningsmidler..
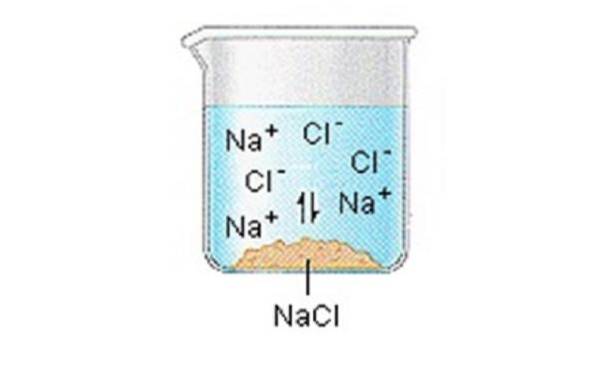
NaCl (s) ”Na + (aq) + Cl- (aq)
Vi kan generelt antage, at salte adskiller sig i deres ioner, når de opløses i vand..
Ioniske forbindelser opløses i vand, hvis den energi, der frigøres, når ionerne interagerer med vandmolekylerne, opvejer den nødvendige energi til at bryde ionbindinger i det faste stof og den nødvendige energi til at adskille vandmolekylerne, så ionerne kan indsættes i opløsningen.
Opløselighedsregler
Afhængig af en opløsnings opløselighed er der tre mulige resultater:
1) Hvis opløsningen har mindre opløst stof end den maksimale mængde, den er i stand til at opløse (dens opløselighed), er det en fortyndet opløsning;
2) Hvis mængden af opløst stof er nøjagtigt den samme mængde som dets opløselighed, er den mættet;
3) Hvis der er mere opløst stof, end der er i stand til at opløses, adskilles det overskydende opløste stof fra opløsningen.
Hvis denne separationsproces inkluderer krystallisation, danner den et bundfald. Nedbør reducerer koncentrationen af det opløste stof til mætning for at øge opløsningens stabilitet..
Følgende er opløselighedsreglerne for almindelige ioniske faste stoffer. Hvis to regler ser ud til at være i modstrid med hinanden, har den foregående forrang.
1- Salte indeholdende gruppe I-elementer (Li+, Na+, K+, Cs+, Rb+) er opløselige. Der er få undtagelser fra denne regel. Salte indeholdende ammoniumionen (NH4+) er også opløselige.
2- Salte indeholdende nitrat (NO3-er generelt opløselige.
3- Saltene, der indeholder Cl -, Br - eller I - er generelt opløselige. Vigtige undtagelser fra denne regel er halogenidsalte af Ag+, Pb2+ og (Hg2)to+. AgCl, PbBrto og HgtoClto de er uopløselige.
4- De fleste af sølvsalte er uopløselige. AgNO3 og Ag (CtoH3ELLERto) er almindelige opløselige salte af sølv; Næsten alle andre er uopløselige.
5- De fleste af sulfatsaltene er opløselige. Vigtige undtagelser fra denne regel inkluderer CaSO4, Baso4, PbSO4, AgtoSO4 og SrSO4.
6- De fleste hydroxidsalte er kun let opløselige. Hydroxidsalte af gruppe I-elementer er opløselige. Hydroxidsalte af elementerne i gruppe II (Ca, Sr og Ba) er let opløselige.
Hydroxidsalte af overgangsmetaller og Al3 + de er uopløselige. Således Fe (OH)3, Al (OH)3, Co (OH)to de er ikke opløselige.
7- De fleste overgangsmetalsulfider er meget uopløselige, herunder CdS, FeS, ZnS og AgtoS. Arsen, antimon, bismuth og bly sulfider er også uopløselige.
8- Carbonater er ofte uopløselige. Gruppe II carbonater (CaCO3, SrCO3 og BaCO3) er uopløselige, ligesom FeCO3 og PbCO3.
9- Chromater er ofte uopløselige. Eksempler inkluderer PbCrO4 og BaCrO4.
10- Phosphater såsom Ca3(PO4)to og Ag3PO4 er ofte uopløselige.
11- Fluorider såsom BaFto, MgFto og PbFto er ofte uopløselige.
Eksempler på opløselighed i vandige opløsninger
Cola, saltvand, regn, syreopløsninger, baseopløsninger og saltopløsninger er eksempler på vandige opløsninger. Når du har en vandig opløsning, kan du fremkalde et bundfald ved udfældningsreaktioner.
Nedbør reaktioner kaldes undertiden "dobbelt forskydning" reaktioner. For at bestemme, om der dannes et bundfald, når vandige opløsninger af to forbindelser blandes:
- Optag alle ioner i opløsning.
- Kombiner dem (kation og anion) for at få alle potentielle nedbør.
- Brug opløselighedsreglerne til at bestemme hvilken (hvis nogen) kombination (er) der er uopløselig og vil udfældes.
Eksempel 1: Hvad sker der når Ba (NO3)to (aq) og NatoCO3 (aq)?
Ioner til stede i opløsning: Bato+, IKKE3-, Na+, CO3to-
Potentielle udfældninger: BaCO3, NaNO3
Opløselighedsregler: BaCO3 er uopløselig (regel 5), NaNO3 er opløselig (regel 1).
Komplet kemisk ligning:
Bad3)to(aq) + NatoCO3(aq) ”BaCO3(s) + 2NaNO3 (aq)
Netionisk ligning:
Bato+(aq) + CO3to-(aq) ”BaCO3 (r)
Eksempel 2: Hvad sker der, når Pb (NO3)to (aq) og NH4I (aq)?
Ioner til stede i opløsning: Pbto+, IKKE3-, NH4+, jeg-
Potentielle udfældninger: PbIto, NH4IKKE3
Opløselighedsregler: PbIto er uopløselig (regel 3), NH4IKKE3 er opløselig (regel 1).
Komplet kemisk ligning: Pb (NO3)2 (aq) + 2NH4jeg(aq) ”PbI2 (r) + 2NH4IKKE3 (aq)
Netionisk ligning: Pbto+(aq) + 2I-(aq) ”PbI2 (r).
Referencer
- Anne Marie Helmenstine. (2017, 10. maj). Vandig definition (vandig opløsning). Gendannet fra thoughtco.com.
- Anne Marie Helmenstine. (2017, 14. maj). Vandig opløsning Definition i kemi. Gendannet fra thoughtco.com.
- Antoinette Mursa, K. W. (2017, 14. maj). Opløselighedsregler. Gendannet fra chem.libretexts.org.
- Vandige løsninger. (S.F.). Gendannet fra saylordotorg.github.io.
- Berkey, M. (2011, 11. november). Vandige løsninger: definition og eksempler. Gendannet fra youtube.com.
- Reaktioner i vandig opløsning. (S.F.). Gendannet fra chemistry.bd.psu.edu.
- Reid, D. (S.F.). Vandig opløsning: Definition, reaktion og eksempel. Gendannet fra study.com.
- Opløselighed. (S.F.). Gendannet fra chemed.chem.purdue.edu.
Endnu ingen kommentarer