
Svovlsyre struktur, egenskaber, nomenklatur, anvendelser
Det svovlsyre er en oxacid, der dannes ved opløsning af svovldioxid, SOto, i vand. Det er en svag og ustabil uorganisk syre, som ikke er detekteret i opløsning, da reaktionen af dens dannelse er reversibel, og syren hurtigt nedbrydes i de reagenser, der producerede den (SOto og HtoELLER).
Svovlsyre-molekylet er indtil videre kun påvist i gasfasen. De konjugerede baser af denne syre er almindelige anioner i form af sulfitter og bisulfitter..
SWto + HtoELLER <=> HSO3- + H+
Dette indikerer, at det ved anvendelse af Raman-spektret ikke er muligt at detektere tilstedeværelsen af svovlsyre i en opløsning af svovldioxid i vand..
Når det udsættes for atmosfæren, bliver det hurtigt til svovlsyre. Svovlsyre reduceres til hydrogensulfid ved virkningen af fortyndet svovlsyre og zink.
Forsøget på at koncentrere en OS-løsningto ved at fordampe vand for at opnå vandfri svovlsyre, gav det ikke resultater, da syren nedbrydes hurtigt (vender dannelsesreaktionen), så syren ikke kan isoleres.
Artikelindeks
- 1 Naturlig dannelse
- 2 Struktur
- 2.1 Isoleret molekyle
- 2.2 Molekyle omgivet af vand
- 2.3 SO2 ∙ nH2O
- 3 Fysiske og kemiske egenskaber
- 3.1 Molekylær formel
- 3.2 Molekylvægt
- 3.3 Fysisk udseende
- 3.4 Tæthed
- 3.5 Dampmassefylde
- 3.6 Korrosivitet
- 3.7 Opløselighed i vand
- 3.8 Følsomhed
- 3.9 Stabilitet
- 3.10 surhedskonstant (Ka)
- 3,11 pKa
- 3,12 pH
- 3.13 Flammepunkt
- 3.14 Nedbrydning
- 4 Nomenklatur
- 5 Syntese
- 6 anvendelser
- 6.1 I skoven
- 6.2 Desinfektions- og blegemiddel
- 6.3 Konserveringsmiddel
- 6.4 Andre anvendelser
- 7 Referencer
Naturlig dannelse
Svovlsyre dannes i naturen ved kombinationen af svovldioxid, et produkt af aktiviteten hos store fabrikker med atmosfærisk vand. Af denne grund betragtes det som et mellemprodukt af sur regn, der forårsager stor skade på landbruget og miljøet..
Dens syreform er ikke anvendelig i naturen, men den fremstilles normalt i dens salte, sulfit og bisulfit af natrium og kalium..
Sulfit genereres endogent i kroppen som et resultat af metabolismen af svovlholdige aminosyrer. Ligeledes fremstilles sulfit som et produkt af gæring af fødevarer og drikkevarer. Sulfit er allergifremkaldende, neurotoksisk og metabolisk. Det metaboliseres af enzymet sulfitoxidase, der omdanner det til sulfat, en harmløs forbindelse.
Struktur
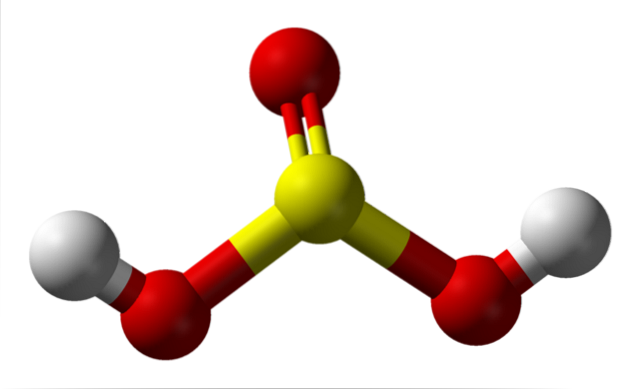
Isoleret, molecule
På billedet kan du se strukturen af et isoleret svovlsyre-molekyle i gasform. Den gule kugle i midten svarer til svovlatomet, de røde til oxygenatomer og de hvide til hydrogenerne. Dens molekylære geometri omkring S-atomet er en trigonal pyramide, hvor O-atomer trækker basen.
Derefter, i gasform, molekylerne af HtoSW3 kan betragtes som små trigonale pyramider, der svæver i luften, forudsat at det er stabilt nok til at vare et stykke tid uden at reagere.
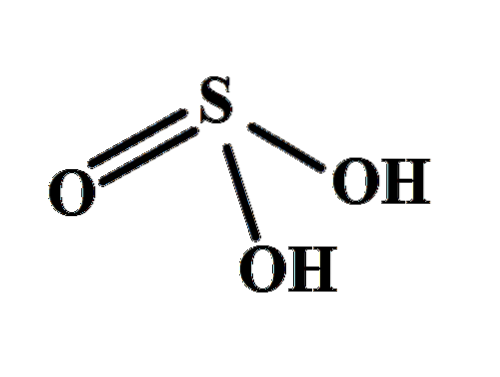
Strukturen gør det klart, hvor de to sure hydrogener kommer fra: fra de svovlbundne hydroxylgrupper, HO-SO-OH. Derfor er det for denne forbindelse ikke korrekt at antage, at en af de sure protoner, H+, frigives fra svovlatomet, H-SOto(OH).
De to OH-grupper tillader svovlsyre at interagere gennem hydrogenbindinger og derudover er oxygenet i S = O-bindingen en hydrogenacceptor, der omdanner HtoSW3 både en god donor og accept af disse broer.
Ifølge ovenstående er HtoSW3 skulle være i stand til at kondensere til en væske, ligesom svovlsyre gør, HtoSW4. Ikke desto mindre er det ikke sådan, det sker.
Molekyle omgivet af vand
Hidtil har det ikke været muligt at opnå vandfri svovlsyre, det vil sige HtoSW3(l); mens HtoSW4(ac) derimod, efter dehydrering, transformerer den til sin vandfri form, HtoSW4(l), som er en tæt og tyktflydende væske.
Hvis det antages, at molekylet af HtoSW3 forbliver uændret, så vil den i høj grad kunne opløses i vand. Interaktionerne, der ville regulere i de nævnte vandige opløsninger, ville igen være hydrogenbindinger; Imidlertid ville elektrostatiske interaktioner også eksistere som et resultat af hydrolyse ligevægten:
HtoSW3(ac) + HtoO (l) <=> HSO3-(ac) + H3ELLER+(ac)
HSO3-(ac) + HtoO (l) <=> SW3to-(ac) + H3ELLER+
Sulfitionen, SO3to- Det ville være det samme molekyle som ovenfor, men uden de hvide kugler; og hydrogensulfit (eller bisulfit) ion, HSO3-, bevarer en hvid kugle. Uendelige salte kan opstå fra begge anioner, nogle mere ustabile end andre.
I virkeligheden er det blevet bekræftet, at en ekstremt lille del af løsningerne består af HtoSW3; det forklarede molekyle er ikke det, der interagerer direkte med vandmolekylerne. Årsagen til dette er, at det gennemgår nedbrydning, der forårsager SOto og HtoEller som er termodynamisk favoriseret.
SWto∙nHtoELLER
Den sande struktur af svovlsyre består af et svovldioxidmolekyle omgivet af en kugle af vand, der består af n molekyler..
Således er SOto, hvis struktur er kantet (boomerang-typen) sammen med sin vandige kugle er ansvarlig for de sure protoner, der karakteriserer surhed:
SWto∙ nHtoO (ac) + HtoO (l) <=> H3ELLER+(ac) + HSO3-(ac) + nHtoO (l)
HSO3-(ac) + HtoO (l) <=> SW3to-(ac) + H3ELLER+
Ud over denne balance er der også en opløselighedsbalance for SOto, hvis molekyle kan flygte fra vand til gasfasen:
SWto(g) <=> SWto(ac)
Fysiske og kemiske egenskaber
Molekylær formel
HtoSW3
Molekylær vægt
82,073 g / mol.
Fysisk fremtoning
Det er en farveløs væske med en skarp lugt af svovl.
Massefylde
1,03 g / ml.
Dampmassefylde
2.3 (i forhold til luft taget som 1)
Ætsende
Det er ætsende for metaller og stoffer.
Vandopløselighed
Blandbar med vand.
Følsomhed
Er følsom over for luft.
Stabilitet
Stabil, men uforenelig med stærke baser.
Surhedskonstant (Ka)
1,54 x 10-to
pKa
1,81
pH
1,5 på pH-skalaen.
antændelsespunkt
Ikke brandfarligt.
Nedbrydning
Ved opvarmning kan svovlsyre nedbrydes og afgive giftig svovloxidrøg..
Nomenklatur
Svovl har følgende valenser: ± 2, +4 og +6. Fra formel HtoSW3, svovlets valens eller oxidationstal i forbindelsen kan beregnes. For at gøre dette skal du bare løse en algebraisk sum:
2 (+1) + 1v + 3 (-2) = 0
Da det er en neutral forbindelse, skal summen af ladningerne for atomerne, der udgør den, være 0. Løsning for v for den foregående ligning har vi:
v = (6-2) / 1
Således er v lig med +4. Det vil sige, svovl deltager med sin anden valens, og ifølge traditionel nomenklatur skal suffikset -oso føjes til navnet. Af denne grund hos HtoSW3 det er kendt som svovlsyrebjørn.
En anden hurtigere måde at bestemme denne valens på er ved at sammenligne HtoSW3 med HtoSW4. I HtoSW4 svovl har en valens på +6, så hvis en O fjernes, falder valensen til +4; og hvis en anden fjernes, falder valensen til +2 (hvilket ville være tilfældet for syre hikkesvovlbjørn, HtoSWto).
Selvom mindre kendt, til HtoSW3 Det kan også kaldes trioxosvovlsyre (IV) ifølge lagernomenklaturen.
Syntese
Teknisk er det dannet ved at brænde svovl for at danne svovldioxid. Dette opløses derefter i vand til dannelse af svovlsyre. Imidlertid er reaktionen reversibel, og syren nedbrydes hurtigt tilbage i reaktanterne..
Dette er en forklaring på, hvorfor svovlsyre ikke findes i vandig opløsning (som allerede nævnt i afsnittet om dens kemiske struktur).
Ansøgninger

Generelt henviser anvendelser og anvendelser af svovlsyre, da dens tilstedeværelse ikke kan detekteres, anvendelser og anvendelser af opløsninger af svovldioxid og syrebaserne og saltene..
I skoven
I sulfitprocessen produceres træmasse i form af næsten rene cellulosefibre. Forskellige salte af svovlsyre bruges til at ekstrahere lignin fra flis ved hjælp af højtryksbeholdere kaldet digistorer..
De salte, der anvendes i processen til opnåelse af træmasse, er sulfit (SO3to-) eller bisulfit (HSO3-afhængigt af pH. Modionen kan være Na+, ACto+, K+ eller NH4+.
Desinfektions- og blegemiddel
-Svovlsyre bruges som desinfektionsmiddel. Det bruges også som et mildt blegemiddel, især til klorfølsomme materialer. Derudover bruges det som tandblegning og tilsætningsstof til fødevarer.
-Det er en ingrediens i forskellige hudplejekosmetik og blev brugt som et pesticidelement ved eliminering af rotter. Fjerner pletter forårsaget af vin eller frugt på forskellige stoffer.
-Det fungerer som et antiseptisk middel og er effektivt til at forhindre hudinfektioner. I nogle øjeblikke blev det brugt til at desinficere skibe, ejendele fra syge ofre for epidemier osv..
Konserveringsmiddel
Svovlsyre bruges som konserveringsmiddel for frugt og grøntsager og for at forhindre gæring af drikkevarer som vin og øl, idet det er et antioxidant, antibakterielt og fungicid element..
Andre anvendelser
-Svovlsyre anvendes til syntesen af lægemidler og kemikalier; i produktionen af vin og øl; raffinering af olieprodukter; og anvendes som et analytisk reagens.
-Bisulfitten reagerer med pyrimidinnukleosiderne og føjer til dobbeltbindingen mellem pyrimidinens 5 og 6 position og modificerer bindingen. Bisulfit-transformation bruges til at teste for sekundære eller højere strukturer af polynukleotider.
Referencer
- Wikipedia. (2018). Svovlsyre. Gendannet fra: en.wikipedia.org
- Nomenklatur for syrer. [PDF]. Gendannet fra: 2.chemistry.gatech.edu
- Tilføjele F. Andreas & col. (2002). Om stabiliteten af svovlsyre (HtoSW3) og dens dimer. Chem. Eur. J. 2002. 8, nr. 24.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., S. 393). Mc Graw Hill.
- Calvo Flores F. G. (s.f.). Uorganisk kemiformulering. [PDF]. Gendannet fra: ugr.es
- PubChem. (2018). Svovlsyre. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Steven S. Zumdahl. (15. august 2008). Oxysyre. Encyclopædia Britannica. Gendannet fra: britannica.com



Endnu ingen kommentarer