
Hvad er degenererede orbitaler?
Det degenererede orbitaler de er alle dem, der er på samme energiniveau. I henhold til denne definition skal de have det samme hovedkvantumnummer n. Således er 2s og 2p orbitaler degenererede, da de hører til energiniveau 2. Det vides imidlertid, at deres vinkel- og radiale bølgefunktioner er forskellige.
Som værdierne af n, elektronerne begynder at optage andre energiniveauer, såsom d- og f-orbitalerne. Hver af disse orbitaler har deres egne egenskaber, som ved første øjekast kan ses i deres vinkelform; Disse er de sfæriske (s), håndvægte (p), kløverblad (d) og kugleformede (f) figurer.
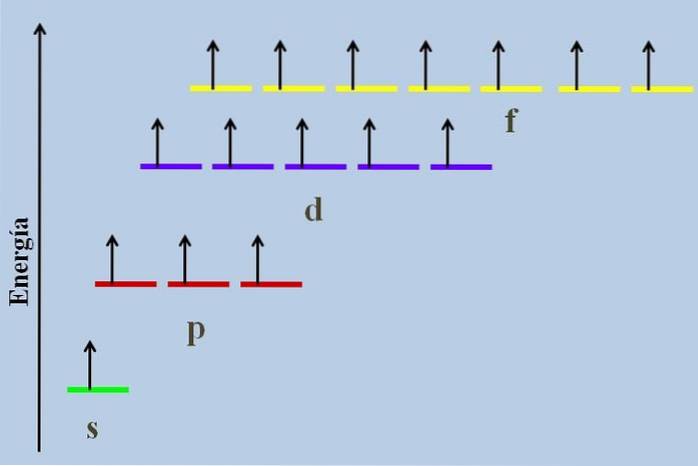
Mellem dem er der en energisk forskel, selvom de hører til det samme niveau n.
For eksempel viser billedet ovenfor et energiskema med orbitalerne optaget af uparrede elektroner (et unormalt tilfælde). Det kan ses, at af alle de mest stabile (den med den laveste energi) er ns (1s, 2s, ...) orbital, mens nf er den mest ustabile (den med den højeste energi).
Artikelindeks
- 1 Degenererede orbitaler i et isoleret atom
- 1.1 Orbitaler s
- 1.2 Orbitaler d
- 1.3 Orbitaler f
- 2 Degenererede hybridorbitaler
- 3 Referencer
Degenererede orbitaler i et isoleret atom
Degenererede orbitaler med den samme værdi af n, de er på samme linje i et energiskema. Af denne grund er de tre røde striber, der symboliserer p-orbitalerne, placeret på samme linje; ligesom de lilla og gule striber på samme måde.
Diagrammet på billedet overtræder Hunds regel: orbitalerne med højere energi er fyldt med elektroner uden først at parre dem med de lavere energien. Når elektronerne parrer sig, mister orbitalen energi og udøver en større elektrostatisk frastødning på de uparrede elektroner fra de andre orbitaler..
Imidlertid betragtes sådanne effekter ikke i mange energidiagrammer. Hvis ja, og adlyde Hunds styre uden fuldstændigt at udfylde d-orbitalerne, ville det ses, at de holder op med at blive degenererede.
Som tidligere nævnt har hver orbital sine egne egenskaber. Et isoleret atom med sin elektroniske konfiguration har sine elektroner arrangeret i det nøjagtige antal orbitaler for at rumme dem. Kun de med samme energi kan betragtes som degenererede.
Orbitaler s
De tre røde striber til degenererede p-orbitaler i billedet indikerer, at begge px, sY Og sz de har den samme energi. Der er en ikke-parret elektron i hver, beskrevet af fire kvantetal (n, l, ml Y Frk), mens de første tre beskriver orbitalerne.
Den eneste forskel mellem dem er betegnet med det magnetiske øjeblik ml, der trækker stien til sx på en x-akse, sY på y-aksen og pz på z-aksen. Alle tre er ens, men adskiller sig kun i deres rumlige orientering. Af denne grund trækkes de altid på linje med energi, det vil sige degenererede.
Da de er de samme, et isoleret nitrogenatom (med 1s konfigurationto2sto2 s3) skal holde sine tre p orbitaler degenererede. Energiscenariet ændres imidlertid brat, hvis man overvejer et N-atom i et molekyle eller en kemisk forbindelse..
Hvorfor? Fordi selvom sx, sY Og sz de har samme energi, dette kan variere i hver enkelt af dem, hvis de har forskellige kemiske miljøer; det vil sige, hvis de binder til forskellige atomer.
Orbitaler d
Der er fem lilla striber, der betegner d-orbitalerne. Selvom de har parrede elektroner, betragtes disse fem orbitaler i et isoleret atom som degenererede. Men i modsætning til p-orbitalerne er der denne gang en markant forskel i deres vinkelformer.
Derfor bevæger dets elektroner sig retninger i rummet, der varierer fra en d-orbital til en anden. Dette forårsager ifølge teori om krystalfelt, at en minimal forstyrrelse forårsager en opdeling af energi af orbitalerne; de fem lilla striber adskiller sig, hvilket efterlader et energigab mellem dem:
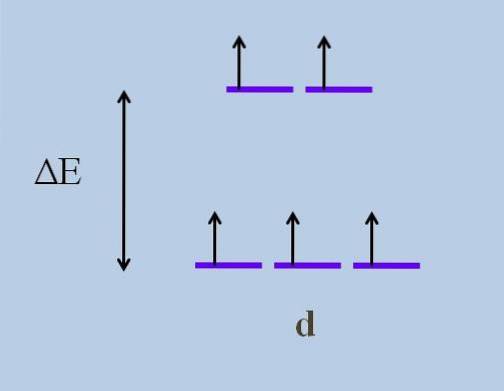
Hvad er de øverste orbitaler, og hvad er de nederste orbitaler? Ovenstående er symboliseret som ogg, og dem nedenfor t2 g. Bemærk, hvordan oprindeligt alle de lilla striber var justeret, og nu blev der dannet et sæt med to orbitaler ogg mere energisk end det andet sæt med tre orbitaler t2 g.
Denne teori giver os mulighed for at forklare d-d-overgange, som mange af de farver, der observeres i forbindelserne til overgangsmetalerne (Cr, Mn, Fe osv.) Tilskrives. Og hvad er årsagen til denne elektroniske forstyrrelse? Til koordination interaktioner mellem metalcentret og andre kaldte molekyler ligander.
Orbitaler f
Og med f orbitalerne, de følte gule striber, bliver situationen endnu mere kompliceret. Deres rumlige retninger varierer meget mellem dem, og visningen af deres links bliver for kompleks.
Faktisk anses f-orbitalerne for at være så indvendigt beklædt, at de ikke "deltager mærkbart" i dannelsen af obligationer..
Når det isolerede atom med f orbitaler omgiver sig med andre atomer, begynder interaktioner og udfolder sig (tabet af degeneritet):
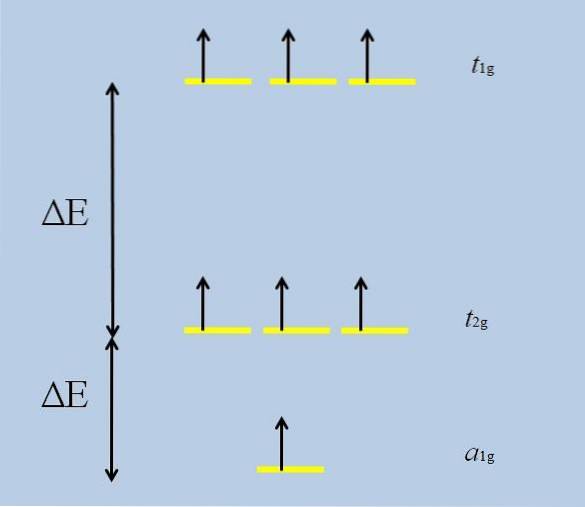
Bemærk, at de gule striber nu danner tre sæt: t1 g, t2 g Y til1 g, og at de ikke længere er degenererede.
Degenererede hybridorbitaler
Det er blevet set, at orbitalerne kan udfolde sig og miste degeneration. Selvom dette forklarer elektroniske overgange, lyser det imidlertid op med at belyse, hvordan og hvorfor der er forskellige molekylære geometrier. Det er her hybridorbitaler kommer ind..
Hvad er dens vigtigste egenskaber? At de er degenererede. Således stammer de fra blandingen af tegn fra orbitaler s, p, d og f for at stamme degenererede hybrider.
For eksempel blandes tre p-orbitaler med et s for at give fire sp-orbitaler3. Alle sp-orbitaler3 er degenererede og har derfor den samme energi.
Hvis der desuden blandes to d orbitaler med de fire sp3, du får seks sp orbitaler3dto.
Og hvordan forklarer de molekylære geometrier? Da der er seks, med samme energi, skal de derfor orienteres symmetrisk i rummet for at generere lige kemiske miljøer (for eksempel i en MF-forbindelse6).
Når de gør det, dannes en koordinationsoktaeder, der er lig med en oktaedrisk geometri omkring et centrum (M).
Imidlertid er geometrier ofte forvrængede, hvilket betyder, at selv hybridorbitaler ikke rigtig er helt degenererede. Derfor findes degenererede orbitaler som konklusion kun i isolerede atomer eller i meget symmetriske miljøer..
Referencer
- Chemicool Dictionary. (2017). Definition af Degenerate. Gendannet fra: chemicool.com
- SparkNotes LLC. (2018). Atomer og atomorbitaler. Gendannet fra: sparknotes.com
- Ren kemi. (s.f.). Elektronisk konfiguration. Gendannet fra: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Moreno R. Esparza. (2009). Koordineringskemikursus: Felt og orbitaler. [PDF]. Gendannet fra: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.


Endnu ingen kommentarer