
Siliciumhistorie, egenskaber, struktur, opnåelse, anvendelser
Det silicium Det er et ikke-metallisk og samtidig metalloid element, der er repræsenteret af det kemiske symbol Si. Det er en halvleder, som er en væsentlig del af computere, regnemaskiner, mobiltelefoner, solceller, dioder osv. Det er praktisk taget hovedkomponenten, der har tilladt etableringen af den digitale tidsalder.
Silicium har altid været til stede i kvarts og silikater, begge mineraler udgør ca. 28% af massen af hele jordskorpen. Det er således det næstmest forekommende element på jordens overflade, og det store ørkener og strande giver et perspektiv på, hvor rigeligt det er..

Silicium hører til gruppe 14 i det periodiske system, det samme som kulstof, der er placeret under det. Derfor betragtes dette element som en tetravalent metalloid; Den har fire valenselektroner, og i teorien kan den miste dem alle for at danne kationen Si4+.
En ejendom, den deler med kul, er dens evne til at forbinde hinanden; det vil sige at deres atomer er kovalent bundet til at definere molekylære kæder. Ligeledes kan silicium danne sine egne “kulbrinter”, kaldet silaner..
De dominerende forbindelser af silicium i naturen er de berømte silikater. I sin rene form kan det fremstå som et monokrystallinsk, polykrystallinsk eller amorft fast stof. Det er et relativt inaktivt fast stof, så det udgør ikke væsentlige risici.
Artikelindeks
- 1 Historie
- 1.1 Siliciumstenen
- 1.2 Isolering
- 1.3 Krystallinsk silicium
- 2 Fysiske og kemiske egenskaber
- 2.1 Fysisk udseende
- 2.2 Molær masse
- 2.3 Atomnummer (Z)
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Tæthed
- 2.7 Fusionsvarme
- 2.8 Fordampningsvarme
- 2.9 Molær varmekapacitet
- 2.10 Elektronegativitet
- 2.11 Ioniseringsenergier
- 2.12 Atomeradius
- 2.13 Varmeledningsevne
- 2.14 Elektrisk modstand
- 2.15 Mohs hårdhed
- 2.16 Sammenkædning
- 2.17 oxidationstal
- 2.18 Reaktivitet
- 3 Struktur og elektronisk konfiguration
- 3.1 Kovalent karakter
- 3.2 Elektrisk ledningsevne
- 3.3 Amorft silicium
- 4 Hvor kan man finde og hente
- 4.1 -Reduktion af silica
- 5 isotoper
- 6 risici
- 7 anvendelser
- 7.1 Byggebranchen
- 7.2 Glas og keramik
- 7.3 Legeringer
- 7.4 Tørremiddel
- 7.5 Elektronisk industri
- 7.6 Silikone polymerer
- 8 Referencer
Historie
Silikone
Silicium er måske et af de elementer, der har haft mest indflydelse i menneskehedens historie.
Dette element er hovedpersonen i stenalderen og også i den digitale tidsalder. Dens oprindelse dateres tilbage til, da civilisationer engang arbejdede med kvarts og lavede deres egne briller; og i øjeblikket er det hovedkomponenten i computere, laptops og smartphones.
Silicium har praktisk taget været sten af to tydeligt definerede epoker i vores historie.
Isolation
Da silica er så rigeligt, et navn født af flintsten, må det have indeholdt et ekstremt rigt element i jordskorpen; dette var den rigtige mistanke for Antoine Lavoisier, der i 1787 mislykkedes i hans forsøg på at reducere den fra sin rust.
Nogen tid senere, i 1808, gjorde Humphry Davy sine egne forsøg og gav elementet sit fornavn: 'silicium', som oversættes til at blive som 'flintmetal'. Det vil sige, silicium blev derefter betragtet som et metal på grund af dets manglende karakterisering..
I 1811 lykkedes det de franske kemikere Joseph L. Gay-Lussac og Louis Jacques Thénard for første gang at fremstille amorft silicium. Til dette reagerede de siliciumtetrafluoridet med metallisk kalium. Imidlertid rensede eller karakteriserede de ikke det opnåede produkt, så de konkluderede ikke, at det var det nye element silicium.
Det var først i 1823, at den svenske kemiker Jacob Berzelius opnåede et amorft silicium med tilstrækkelig renhed til at genkende det som silicium; navn givet i 1817 af den skotske kemiker Thomas Thomson, når man betragter det som et ikke-metallisk element. Berzelius udførte reaktionen mellem kaliumfluorosilikat og smeltet kalium for at producere dette silicium.
Krystallinsk silicium
Krystallinsk silicium blev først fremstillet i 1854 af den franske kemiker Henry Deville. For at opnå dette udførte Deville en elektrolyse af en blanding af aluminium og natriumchlorider og opnåede således siliciumkrystaller dækket af et lag aluminiumsilicid, som han eliminerede (tilsyneladende) ved at vaske dem med vand..
Fysiske og kemiske egenskaber
Fysisk fremtoning

Silicium i sin rene eller elementære form består af et gråligt eller blåsort fast stof (øverste billede), som skønt det ikke er et metal, men med skinnende ansigter, som om det virkelig var.
Det er et hårdt, men skørt, fast stof, der også udviser en skællet overflade, hvis den består af polykrystaller. Amorft silicium ser derimod ud som et mørkebrunt pulverformigt fast stof. Takket være dette er det let at identificere og differentiere en type silicium (krystallinsk eller polykrystallinsk) fra en anden (amorf).
Molar masse
28,085 g / mol
Atomnummer (Z)
14 (14Ja)
Smeltepunkt
1414 ºC
Kogepunkt
3265 ºC
Massefylde
-Ved stuetemperatur: 2,33 g / ml
-Lige ved smeltepunktet: 2,57 g / ml
Bemærk, at flydende silicium er tættere end fast silicium; hvilket betyder, at dets krystaller flyder på en flydende fase af den samme, som det sker med isvandssystemet. Forklaringen skyldes det faktum, at det interatomære rum mellem Si-atomerne i deres krystal er større (mindre tæt) end det tilsvarende i væsken (mere tæt).
Fusionsvarme
50,21 kJ / mol
Fordampningsvarme
383 kJ / mol
Molær varmekapacitet
19,789 J / (mol K)
Elektronegativitet
1,90 på Pauling-skalaen
Ioniseringsenergier
-Først: 786,5 kJ / mol
-Andet: 1577,1 kJ / mol
-Tredje: 3231,6 kJ / mol
Atomic radio
111 pm (målt på deres respektive diamantkrystaller)
Varmeledningsevne
149 W / (m K)
Elektrisk modstand
2.3 103 Ω · m ved 20 ºC
Mohs hårdhed
6.5
Sammenkædning
Siliciumatomer har evnen til at danne enkle Si-Si-bindinger, som ender med at definere en kæde (Si-Si-Si ...).
Denne egenskab manifesteres også af kulstof og svovl; dog sp hybridiseringer3 silicium er mere mangelfuld sammenlignet med de to andre grundstoffer, og derudover er deres 3p-orbitaler mere diffuse, så overlapningen af sp-orbitalerne3 resulterende er svagere.
De gennemsnitlige energier af Si-Si og C-C kovalente bindinger er henholdsvis 226 kJ / mol og 356 kJ / mol. Derfor er Si-Si-obligationer svagere. På grund af dette er silicium ikke livets hjørnesten (og heller ikke svovl). Faktisk er det længste kæde eller skelet, som silicium kan danne, normalt firleddet (Si4).
Oxidationsnumre
Silicium kan have et hvilket som helst af følgende oxidationstal, idet det antages i hver af dem eksistensen af ioner med deres respektive ladninger: -4 (Si4-), -3 (Ja3-), -2 (Jato-), -1 (Ja-), +1 (Ja+), +2 (Jato+), +3 (Ja3+) og +4 (Ja4+). Af dem alle er -4 og +4 de vigtigste.
For eksempel antages -4 i silicider (MgtoJa eller Mgtoto+Ja4-); mens +4 svarer til silica (SiOto eller hvis4+ELLERtoto-).
Reaktivitet
Silicium er fuldstændig uopløseligt i vand såvel som stærke syrer eller baser. Det opløses imidlertid i en koncentreret blanding af salpetersyre og flussyre (HNO)3-HF). Ligeledes opløses den i en varm alkalisk opløsning med følgende kemiske reaktion:
Si (s) + 2NaOH (aq) + HtoO (l) => NatoJa3(aq) + 2Hto(g)
Natriummetasilikatsaltet, NatoJa3, Det dannes også, når silicium opløses i smeltet natriumcarbonat:
Si (s) + NatoCO3(l) => NatoJa3(l) + C (s)
Ved stuetemperatur reagerer den slet ikke med ilt, ikke engang ved 900 ºC, når et beskyttende glasagtigt lag af SiO begynder at dannesto; og derefter, ved 1400 ºC, reagerer silicium med nitrogenet i luften til dannelse af en blanding af nitrider, SiN og Si3N4.
Silicium reagerer også ved høje temperaturer med metaller til dannelse af metalsilicider:
2Mg (s) + Si (s) => MgtoJa (r)
2Cu (s) + Si (s) => CutoJa (r)
Ved stuetemperatur reagerer den eksplosivt og direkte med halogener (der er intet SiO-lagto for at beskytte dig mod dette). For eksempel har vi reaktionen ved dannelse af SiF4:
Ja (r) + 2Fto(g) => SiF4(g)
Og selvom silicium er uopløseligt i vand, reagerer det rødvarmt med en dampstrøm:
Ja (r) + HtoO (g) => SiOto(s) + 2Hto(g)
Struktur og elektronisk konfiguration
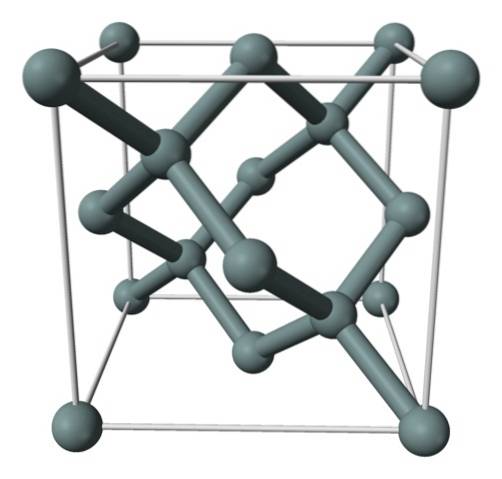
Ovenstående billede viser den ansigtscentrerede kubiske struktur (fcc), den samme som diamant, for siliciumkrystal. De grålige kugler svarer til Si-atomerne, som, som det ses, er kovalent bundet til hinanden; derudover har de tetraedriske miljøer, der gengives langs krystallen.
Siliciumkrystallen er fcc, fordi et Si-atom observeres placeret på hver af terningens ansigter (6 × 1/2). Ligeledes er der otte Si-atomer ved terningens hjørner (8 × 1/8) og fire placeret inde i den (dem der viser en veldefineret tetraeder omkring dem, 4 × 1).
Når det er sagt, har hver enhedscelle i alt otte siliciumatomer (3 + 1 + 4, tal angivet i ovenstående afsnit); egenskab, der hjælper med at forklare dens høje hårdhed og stivhed, da rent silicium er en kovalent krystallignende diamant.
Kovalent karakter
Denne kovalente karakter skyldes, at silicium, ligesom kulstof, har fire valenselektroner i henhold til dets elektroniske konfiguration:
[Ne] 3sto 3pto
Til limning er de rene 3s og 2p orbitaler ubrugelige. Det er derfor, atomet skaber fire hybrid sp-orbitaler3, hvormed den kan danne fire Si-Si kovalente bindinger og på denne måde fuldføre valensoktet for de to siliciumatomer.
Siliciumkrystallen visualiseres derefter som et kovalent, tredimensionelt netværk sammensat af sammenkoblet tetraeder..
Dette netværk er dog ikke perfekt, da det har defekter og korngrænser, der adskiller og definerer en krystal fra en anden; og når sådanne krystaller er meget små og talrige, taler vi om et polykrystallinsk fast stof, identificeret ved dets heterogene glans (svarende til en sølvmosaik eller skællet overflade).
Elektrisk ledningsevne
Si-Si-bindingerne med deres velplacerede elektroner er i princippet uenige med, hvad der forventes af et metal: et hav af elektroner, der "befugter" dets atomer; i det mindste er dette så ved stuetemperatur.
Når temperaturen stiger, begynder silicium imidlertid at lede elektricitet og opfører sig derfor som et metal; det vil sige, det er et halvledermetalloidelement.
Amorft silicium
Silicium tetraeder antager ikke altid et strukturelt mønster, men kan arrangeres på en uordnet måde; og endda med siliciumatomer, hvis hybridiseringer ikke synes at være sp3 men spto, hvilket bidrager til yderligere at øge graden af uorden. Derfor taler vi om et amorft og ikke-krystallinsk silicium.
I amorft silicium er der elektroniske ledige stillinger, hvor nogle af dets atomer har en orbital med en uparret elektron. Takket være dette kan dets faste stof hydreres, hvilket giver anledning til dannelsen af hydrogeneret amorft silicium; det vil sige, den har Si-H-bindinger, hvormed tetraederne fuldføres i uordnede og vilkårlige positioner.
Dette afsnit afsluttes derefter med at sige, at silicium kan præsenteres i tre typer faste stoffer (uden at nævne dets renhedsgrad): krystallinsk, polykrystallinsk og amorf..
Hver af dem har sin egen produktionsmetode eller -proces såvel som dets anvendelser og afvejninger, når de beslutter, hvilken af de tre der skal bruges, idet de ved dens fordele og ulemper..
Hvor kan man finde og få

Silicium er det syvende mest forekommende element i universet og det andet i jordskorpen, der også beriger jordens kappe med sin store familie af mineraler. Dette element forbinder ekstremt godt med ilt og danner en bred vifte af oxider; blandt dem, silica, SOto, og silikater (med forskellig kemisk sammensætning).
Silica kan ses med det blotte øje i ørkener og strande, da sand hovedsageligt består af SiOto. Til gengæld kan denne oxid forekomme i nogle få polymorfe, hvor den mest almindelige er: kvarts, ametyst, agat, cristobalit, tripoli, coesit, stishovit og tridymit. Derudover kan den findes i amorfe faste stoffer, såsom opaler og kiselgur..
Silicater er i mellemtiden endnu rigere strukturelt og kemisk. Nogle af silikatmineraler inkluderer: asbest (hvid, brun og blålig), feltspat, ler, micas, oliviner, aluminosilicater, zeolitter, amfiboler og pyroxener.
Næsten alle klipper er sammensat af silicium og ilt med deres stabile Si-O-bindinger og deres silicaer og silicater blandet med metaloxider og uorganiske arter..
-Reduktion af silica
Problemet med at opnå silicium bryder Si-O-bindingen, for hvilken der er behov for specielle ovne og en god reduktionsstrategi. Råmaterialet til denne proces er silica i form af kvarts, som tidligere er formalet, indtil det er et fint pulver..
Fra dette formalet silica kan der fremstilles enten amorft eller polykrystallinsk silicium..
Amorft silicium
I lille skala, udført i et laboratorium og med passende foranstaltninger, blandes silica med magnesiumpulver i en digel og forbrændes i fravær af luft. Følgende reaktion finder derefter sted:
Jato(s) + Mg (s) => 2MgO (s) + Si (s)
Magnesium og dets oxid fjernes med en fortyndet saltsyreopløsning. Derefter behandles det resterende faste stof med flussyre, således at SiO er færdig med at reagereto i overskud; ellers favoriserer overskuddet af magnesium dannelsen af dets respektive silicid, MgtoJa, uønsket forbindelse til processen.
SiOto bliver den flygtige gas SiF4, som udvindes til andre kemiske synteser. Endelig tørres den amorfe siliciummasse under en strøm af hydrogengas..
En anden lignende metode til opnåelse af amorft silicium er at anvende den samme SiF4 tidligere produceret eller SiCl4 (tidligere købt). Dampene fra disse siliciumhalogenider ledes over flydende natrium i en inert atmosfære, så reduktionen af gassen kan finde sted uden tilstedeværelse af ilt:
SiCl4(g) + 4Na (l) => Si (s) + 4NaCl (l)
Interessant nok bruges amorft silicium til at fremstille højeffektive solpaneler.
Krystallinsk silicium
Startende igen fra pulveriseret silica eller kvarts føres de til en lysbueovn, hvor de reagerer med koks. På denne måde er reduktionsmidlet ikke længere et metal, men et kulstofholdigt materiale med høj renhed:
Jato(s) + 2C (s) => Si (s) + 2CO (g)
Reaktionen producerer også siliciumcarbid, SiC, som neutraliseres med et overskud af SiOto (igen er kvartset i overskud):
2SiC (s) + SiOto(s) => 3Si (s) + 2CO (g)
En anden metode til fremstilling af krystallinsk silicium er at bruge aluminium som reduktionsmiddel:
3JAto(s) + 4Al (l) => 3Si (s) + 2AltoELLER3(s)
Og startende fra kaliumhexafluorurosilikatsaltet, Kto[SiF6], reageres det også med metallisk aluminium eller kalium for at producere det samme produkt:
Kto[SiF6] (l) + 4Al (l) => 3Si (s) + 6KF (l) + 4AlF3(g)
Silicium opløses straks i smeltet aluminium, og når systemet afkøles, krystalliserer det første og adskiller sig fra det andet; det vil sige, der dannes siliciumkrystaller, der fremstår grålige farver.
Polykrystallinsk silicium
I modsætning til de andre synteser eller produktioner starter man med en silangasfase, SiH, for at opnå polykrystallinsk silicium.4. Denne gas udsættes for en pyrolyse over 500 ºC på en sådan måde, at der opstår en termisk nedbrydning, og polykrystaller af silicium bliver således fra dets indledende dampe aflejret på en halvlederoverflade.
Den følgende kemiske ligning eksemplificerer den reaktion, der finder sted:
Ja H4(g) => Si (s) + Hto(g)
Der skal åbenbart ikke være noget ilt i kammeret, da det vil reagere med SiH4:
Ja H4(g) + 20to(g) => SiOto(s) + 2HtoO (g)
Og sådan er spontaniteten af forbrændingsreaktionen, at den sker hurtigt ved stuetemperatur med minimal udsættelse af silanen for luft..
En anden syntetisk vej til fremstilling af denne type silicium starter fra krystallinsk silicium som råmateriale. De får det til at reagere med hydrogenchlorid ved en temperatur på omkring 300 ºC, således at trichlorsilan således dannes:
Si (s) + 3 HCI (g) => SiCl3H (g) + Hto(g)
Og SiCl3H reagerer ved 1100 ºC for at regenerere silicium, men nu polykrystallinsk:
4SiCl3H (g) => Si (s) + 3SiCl4(g) + 2Hto(g)
Se bare på ligningerne for at få en idé om det arbejde og de strenge produktionsparametre, der skal overvejes..
Isotoper
Silicium forekommer naturligt og hovedsageligt som isotopen 28Ja, med en overflod på 92,23%.
Ud over dette er der to andre isotoper, der er stabile og derfor ikke gennemgår radioaktivt henfald: 29Ja, med en overflod på 4,67%; Y 30Ja, med en overflod på 3,10%. At være så rigelig 28Ja, det er ikke overraskende, at atomvægten af silicium er 28,084 u.
Silicium kan også findes i flere radioisotoper, blandt hvilke er 31Ja (t1/2= 2,62 timer) og 32Ja (t1/2= 153 år). Andre (22Ja - 44Hvis de har t1/2 meget kort eller kort (mindre end hundrededele af et sekund).
Risici
Rent silicium er et relativt inert stof, så det ophobes normalt ikke i noget organ eller væv, så længe eksponeringen for det er lav. I pulverform kan det irritere øjnene og forårsage rive eller rødme, mens du rører ved det kan forårsage ubehag i huden, kløe og afskalning..
Når eksponeringen er meget høj, kan silicium beskadige lungerne; men uden eftervirkninger, medmindre mængden er tilstrækkelig til at forårsage kvælning. Dette er dog ikke tilfældet med kvarts, som er forbundet med lungekræft og sygdomme som bronkitis og emfysem..
Ligeledes er rent silicium meget sjældent i naturen, og dets forbindelser, der er så rigelige i jordskorpen, udgør ingen risiko for miljøet..
Nu, med hensyn til organosilicium, kunne disse være giftige; Men da der er mange af dem, afhænger det af, hvilken der overvejes, samt andre faktorer (reaktivitet, pH, virkningsmekanisme osv.).
Ansøgninger
Byggeindustrien
Siliciummineraler udgør den "sten", hvormed bygninger, huse eller monumenter er bygget. For eksempel består cement, beton, stuk og ildfast mursten af faste blandinger baseret på silikater. Fra denne tilgang kan man forestille sig nytten af dette element i byer og arkitektur..
Glas og keramik
Krystaller, der anvendes i optiske enheder, kan fremstilles af silica, hvad enten de er isolatorer, prøveceller, spektrofotometre, piezoelektriske krystaller eller blotte linser..
Når materialet fremstilles med flere additiver, ender det ligeledes med at omdanne til et amorft fast stof, kendt som glas; og bjerge af sand er normalt kilden til det silicium eller kvarts, der er nødvendigt for dets produktion. På den anden side fremstilles keramiske materialer og porcelæn med silicater.
Sammenflettede ideer, silicium er også til stede i håndværk og udsmykning.
Legeringer
Siliciumatomer kan smelte sammen og være blandbare med en metallisk matrix, hvilket gør det til et additiv til mange legeringer eller metaller; for eksempel stål til fremstilling af magnetiske kerner; bronze til fremstilling af telefonkabler; og aluminium til produktion af aluminium-siliciumlegering bestemt til lette bildele.
Derfor kan det ikke kun findes i "sten" i bygninger, men også i metaller i deres søjler..
Tørremidler

Silica, i gel eller amorf form, gør det muligt at fremstille faste stoffer, der fungerer som tørremiddel ved at fange vandmolekylerne, der kommer ind i beholderen, og holde dets indre tørt..
Elektronisk industri

Siliciumlag i forskellige tykkelser og farver er en del af computerchips, da deres faste (krystallinske eller amorfe) integrerede kredsløb og solceller er designet.
At være en halvleder, det inkorporerer atomer med mindre (Al, B, Ga) eller flere elektroner (P, As, Sb) for at omdanne det til halvledere af typen s eller n, henholdsvis. Med krydset mellem to silikoner, den ene n og den anden s, der fremstilles lysdioder.
Silikone polymerer
Den berømte silikone lim består af en organisk polymer understøttet af stabiliteten af kæderne af Si-O-Si bindinger ... Hvis disse kæder er meget lange, korte eller tværbundet, ændres silikonepolymerens egenskaber såvel som deres endelige ansøgninger..
Blandt dets anvendelser, der er anført nedenfor, kan følgende nævnes:
-Lim eller klæbemiddel, ikke kun til sammenføjning af papirer, men også byggesten, gummi, glaspaneler, sten osv..
-Smøremidler i hydrauliske bremsesystemer
-Styrker maling og forbedrer lysstyrken og intensiteten af deres farver, samtidig med at de kan modstå ændringer i temperaturen uden at revne eller spise væk.
-De bruges som vandafvisende spray, som holder nogle overflader eller genstande tørre
-De giver personlige hygiejneprodukter (tandpastaer, shampoo, geler, barbercremer osv.) Følelsen af at være silkeagtig
-Belægningerne beskytter de elektroniske komponenter i sarte enheder, såsom mikroprocessorer, mod varme og fugt
-Med silikonepolymerer er der lavet adskillige af gummikuglerne, der hopper, så snart de falder ned på gulvet..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Silicium. Gendannet fra: en.wikipedia.org
- Mikrokemikalier. (s.f.). Krystallografi af silicium. Gendannet fra: microchemicals.com
- Lenntech B.V. (2019). Periodisk system: silicium. Gendannet fra: lenntech.com
- Marques Miguel. (s.f.). Silicium-forekomst. Gendannet fra: nautilus.fis.uc.pt
- Mere Hemant. (5. november 2017). Silicium. Gendannet fra: hemantmore.org.in
- Pilgaard Michael. (22. august 2018). Silicium: Forekomst, isolering og syntese. Gendannet fra: pilgaardelements.com
- Dr. Doug Stewart. (2019). Fakta om siliciumelement. Chemicool. Gendannet fra: chemicool.com
- Christiana Honsberg og Stuart Bowden. (2019). En samling ressourcer til fotovoltaisk underviser. PV-uddannelse. Gendannet fra: pveducation.org
- American Chemistry Council, Inc. (2019). Silikoner i hverdagen. Gendannet fra: sehsc.americanchemistry.com



Endnu ingen kommentarer