
Endoterm og exoterm reaktion

EN endoterm reaktion kræver strøm, mens a eksoterm reaktion frigiver energi. Denne klassificering af kemiske reaktioner tager højde for deltagelsen af energi enten som en reaktant eller som et produkt..
Energi er evnen til at udføre arbejde eller til at producere varme. Husk, at kemiske reaktioner involverer en omorganisering af atomer mellem stoffer med brud eller dannelse af kemiske bindinger. Generelt ledsages denne dannelse eller afbrydelse af kemiske bindinger af ændringer i systemets energi..
| Endoterm reaktion | Eksoterm reaktion | |
|---|---|---|
| Definition | Kemisk reaktion, hvor energi absorberes. | Kemisk reaktion, hvor energi frigives i form af varme. |
| Oprindelse af energi | Af miljøet | Af systemet |
| Potentiel energi | Lavere i reaktanter end i produkter. | Større i reaktanter end i produkter. |
| Produktion | Ikke spontan | Spontan |
| Intern energiændring | AE> 0; intern energiændring større end nul. | ΔE<0; cambio de energía interna menor que cero. |
| Temperatur | Fald | Stiger |
| Eksempler | Reaktioner i fotosyntese og syntese generelt. | En brændende tændstik, forbrændingsreaktioner. |
Hvad er en endoterm reaktion?
En kemisk reaktion er endoterm, når absorberer energi fra miljøet. I dette tilfælde overføres varmen udefra til indersiden af systemet. Når vi placerer et termometer, mens den endotermiske reaktion finder sted, falder temperaturen.
Ordet "endoterm" stammer fra græsk endon hvilket betyder "inde" og terme hvilket betyder "varme". Endotermiske reaktioner forløber ikke spontant.
Hvor kommer energien fra i endotermiske reaktioner?
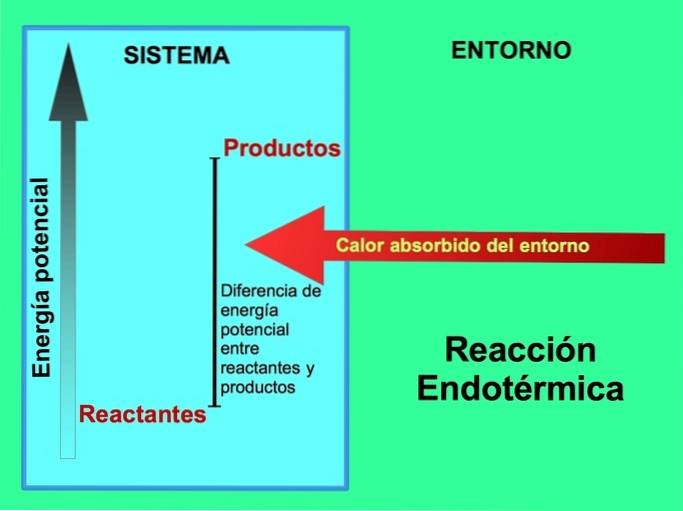
I endotermiske reaktioner kommer energien fra miljøet uden for systemet. Mængden af potentiel energi af produkterne er større end den potentielle energi for reaktanterne. Derfor er det nødvendigt at tilføje energi til reaktanterne for at reaktionen kan fortsætte. Denne energi kommer fra varmen fra miljøet.
For eksempel, fotosyntese er en endoterm proces, hvor planter fanger solenergi for at producere glukose fra kuldioxid og ilt:

Produkterne fra fotosyntese-reaktionen, glucose og ilt, har en større mængde potentiel energi i forhold til reaktanterne, kuldioxid og vand. Andre eksempler på endotermiske kemiske reaktioner med den anvendte energimængde:

Eksempler på endoterm reaktion
Det er ikke kun i kemilaboratoriet, at reaktioner opstår. I dag til dag finder vi også situationer, hvor endotermiske reaktioner opstår.
Madlavning
Selvom det måske ikke ser ud som det, er processen med madlavning endoterm. For at forbruge visse fødevarer skal vi levere varme.
Øjeblikkelig koldpose
Kolde pakninger, der bruges til at behandle ujævnheder eller forstuvninger, er fyldt med vand, men når de rystes eller bankes, bryder en kapsel indeholdende ammoniumnitrat inde. Blanding af ammoniumnitrat med vand er en endoterm reaktion, der får posen til at køle af.
Hvad er en eksoterm reaktion?
EN exoterm reaktion er en, hvor energi strømmer ud af systemet. Denne energi frigives i form af varme, så placering af et termometer i reaktionssystemet øger temperaturen.
Ordet "eksoterm" er dannet af exo hvilket betyder "udad" og termer, hvilket betyder "varme". Eksoterme reaktioner kan forekomme spontant og i nogle tilfælde være eksplosive, såsom kombinationen af alkalimetaller og vand.
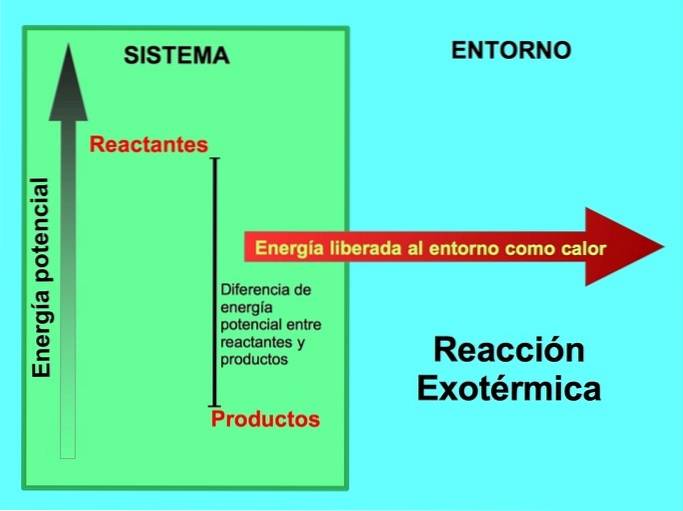
Hvor kommer energien fra i eksoterme reaktioner?
I en kemisk reaktion er reaktanter de forbindelser, der transformerer og giver produkter. For eksempel, når natrium Na reagerer med chlor Cl, er dette reaktanterne, og produktet er natriumchlorid NaCl:
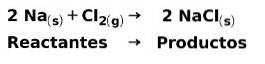
Både reaktanter og produkter har lagret potentiel energi. Vi kender fra lenergibesparelse ey at energi hverken går tabt eller vindes, så reaktanternes energi skal være lig med produkternes.
I en eksoterm reaktion, lreaktanter har mere potentiel energi sammenlignet med produkter, så overskydende energi frigives som varme. I dette tilfælde betragtes energi også som en del af produkterne:

I enhver eksoterm proces omdannes en del af den potentielle energi, der er lagret i kemiske bindinger, til termisk energi gennem varme..
Eksempler på eksoterm reaktion
Vaskemiddel
Når vi opløser lidt vaskepulver med vand i vores hænder, kan vi mærke en let opvarmning.
Forbrænding af husholdningsgas
Forbrændingen af gasser til husholdningsbrug, såsom metan eller butan, involverer den kemiske reaktion med ilt med dannelsen af kuldioxid og vand og frigivelse af energi. Dette er en typisk exoterm reaktion i daglig brug:
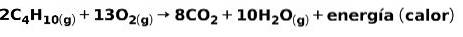
Den energi, der frigøres i forbrændingsprocessen, bruges til madlavning.
Du kan også være interesseret i at vide, hvad der er åbent system, lukket system og isoleret system.



Endnu ingen kommentarer