
Enkelt, dobbelt forskydningsreaktioner og eksempler
Det forskydningsreaktioner er alle dem, hvor en kemisk art fortrænger en anden i en forbindelse. Denne forskydning kan være enkel eller dobbelt, idet den adskiller sig ved, at den i den første er et element, der forskydes, mens der i den anden er en ændring af "par" mellem to forbindelser..
Disse typer reaktioner er kun mulige under visse betingelser: en af arten skal have et oxidationsnummer på nul, eller alle skal nødvendigvis ioniseres. Hvad betyder et oxidationsnummer på nul? Det betyder, at arten er i sin naturlige tilstand.

Et meget illustrativt eksempel på ovenstående fremgangsmåde er reaktionen mellem en kobbertråd og en sølvnitratopløsning. Da kobber er et metal i dets naturlige tilstand, er dets oxidationsnummer nul; på den anden side er sølv +1 (Ag+), som ligger opløst sammen med nitrationer (NO3-).
Metaller opgiver elektroner, men nogle er mere aktive end andre; Det betyder, at ikke alle metaller ruster så let. Fordi kobber er mere aktiv end sølv, donerer det sine elektroner og reducerer det til sin naturlige tilstand, reflekteret som en sølvoverflade, der dækker kobbertråden (billedet ovenfor).
Artikelindeks
- 1 Forskydningsreaktioner
- 1.1 Enkel
- 1.2 Dobbelt
- 2 Eksempler
- 2.1 Enkel
- 2.2 Dobbelt
- 3 Referencer
Forskydningsreaktioner
Enkel
Forskydning af brint og metaller
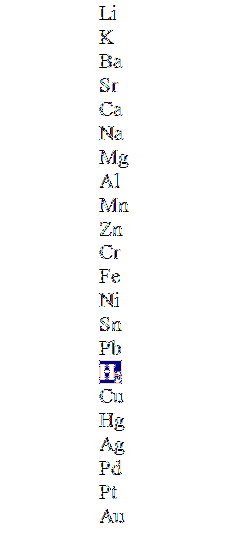
Det øverste billede viser en søjle i faldende rækkefølge efter aktivitet og fremhæver brintmolekylet. De metaller, der er over dette, kan fortrænge det i de ikke-oxiderende syrer (HCI, HF, HtoSW4, osv.), og nedenstående reagerer slet ikke.
Den enkle forskydningsreaktion kan beskrives ved følgende generelle ligning:
A + BC => AB + C
A fortrænger C, som kan være H-molekyletto eller andet metal. Ja Hto dannes ved reduktion af H-ioner+ (2H+ + 2e- => Hto), så skal art A - på grund af bevarelsen af masse og energi - give elektronerne: den skal oxideres.
På den anden side, hvis A og C er metalliske arter, men C er i ionform (M+) og A i sin naturlige tilstand, vil forskydningsreaktionen kun forekomme, hvis A er mere aktiv end C, hvilket tvinger sidstnævnte til at acceptere elektroner for at reducere til dets metalliske tilstand (M).
Forskydning med halogener
På samme måde kan halogener (F, Cl, Br, I, At) bevæge sig med hinanden, men efter en anden række aktiviteter. For disse falder aktiviteten, når man ned gennem gruppe 7A (eller 17): I For eksempel forekommer følgende reaktion naturligt: Fto(g) + 2Nal (ac) => 2NaF (ac) + Ito(s) Denne anden producerer dog ingen produkter af de netop forklarede grunde: jegto(s) + NaF (ac) => X I ovenstående ligning betyder X, at der ikke er nogen reaktion. Med denne viden kan det forudsiges, hvilken blanding af halogensalte med de rene grundstoffer, der producerer produkter. Som en tommelfingerregel fortrænger ikke jod (et flygtigt lilla fast stof) nogen af de andre halogener, men de andre fortrænger det, når de er i ionform (Na+ jeg-). Dobbeltforskydningsreaktionen, også kendt som metatesereaktionen, er repræsenteret som følger: AB + CD => AD + CB Denne gang fortrænger ikke kun A C, men også B fortrænger D. Denne type fortrængning forekommer kun, når opløsninger af opløselige salte blandes, og der dannes et bundfald; dvs. AD eller CB skal være uopløselige og have stærke elektrostatiske interaktioner. For eksempel ved blanding af KBr- og AgNO-løsninger3, de fire ioner bevæger sig gennem mediet, indtil de danner de tilsvarende par af ligningen: KBr (ac) + AgNO3(ac) => AgBr (s) + KNO3(ac) Ag-ioner+ og Br- danne sølvbromidpræcipitatet, mens K+ og nej3- kan ikke arrangeres til at danne en krystal af kaliumnitrat. Når en syre neutraliseres med en base, opstår en dobbelt fortrængningsreaktion: HCI (aq) + NaOH (aq) => NaCl (aq) + HtoO (l) Her dannes der ikke noget bundfald, da natriumchlorid er et meget opløseligt salt i vand, men der sker en pH-ændring, som tilpasser sig en værdi tæt på 7. I den følgende reaktion forekommer imidlertid en ændring i pH og dannelsen af et bundfald samtidigt: H3PO4(ac) + 3Ca (OH)to => Ca.3(PO4)to(s) + 3HtoO (l) Calciumphosphat er uopløseligt og udfældes som et hvidt fast stof, mens phosphorsyre neutraliseres med calciumhydroxid. Cu (s) + 2AgNO3(ac) => Cu (NO3)to(ac) + 2Ag (s) Dette er kobbertrådens billedreaktion. Hvis du ser på rækken af kemiske aktiviteter for metaller, vil du opdage, at kobber er over sølv, så det kan fortrænge det. Zn (s) + CuSO4(ac) => ZnSO4(ac) + Cu (s) Med denne anden reaktion sker det modsatte: nu den blålige opløsning af CuSO4 bliver gennemsigtig, når kobber udfældes som metal, og samtidig opløses metallisk zink i opløseligt zinksulfatsalt. 2Al (s) + 3NiBrto(ac) => 2AlBr3(ac) + 3Ni (s) Igen opstår denne reaktion, fordi aluminium ligger over nikkel i rækken af kemiske aktiviteter. Sn (s) + HtoSW4(ac) => SnSO4(ac) + Hto(g) Her fortrænger tin brint, selvom det er meget tæt på det i serien. 2K (s) + 2HtoO (l) => 2KOH (aq) + Hto(g) Endelig er de metaller, der er i den højeste del af serien, så reaktive, at de fortrænger selv brint i vandmolekylerne og genererer en meget eksoterm (og eksplosiv) reaktion.. Zn (NO3)to(aq) + 2NaOH (aq) => Zn (OH)to(s) + 2NaNO3(ac) Selvom basen ikke neutraliserer nogen syrer, er OH-ionerne- føler mere affinitet med Znto+ at ioner IKKE er3-; af denne grund forekommer den dobbelte forskydning. Frimærke3)to(ac) + NatoS (ac) => CuS (s) + 2NaNO3(ac) Denne reaktion svarer meget til den foregående med den forskel, at begge forbindelser er salte opløst i vand..Dobbelt
Syre-base neutraliseringsreaktion
Eksempler
Enkel
Dobbelt
Referencer

Endnu ingen kommentarer