
Diazoniumsalte Dannelse, egenskaber og applikationer
Det diazoniumsalte er organiske forbindelser, hvor der er ioniske interaktioner mellem azogruppen (-Nto+) og en anion X- (Cl-, F-, CH3COO-, etc.). Dens generelle kemiske formel er RNto+x-, og i dette kan sidekæden R meget vel være en alifatisk gruppe eller en arylgruppe; dvs. en aromatisk ring.
Det nederste billede repræsenterer strukturen af arenediazoniumionen. De blå kugler svarer til azogruppen, mens de sorte og hvide kugler udgør den aromatiske ring af phenylgruppen. Azogruppen er meget ustabil og reaktiv, fordi et af nitrogenatomer har en positiv ladning (-N+≡N).
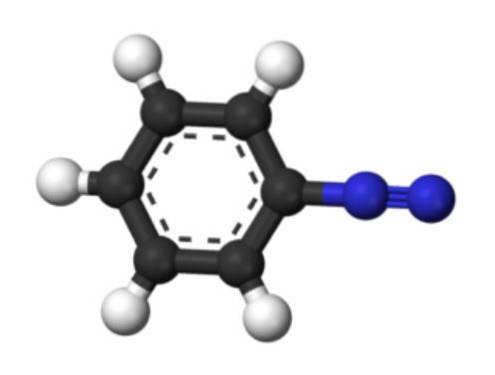
Der er dog resonansstrukturer, der aflokaliserer denne positive ladning, for eksempel på det nærliggende nitrogenatom: -N = N+. Dette stammer fra, når et par elektroner, der danner en binding, går til nitrogenatomet til venstre.
Ligeledes er denne positive ladning i stand til at blive lokaliseret af Pi-systemet i den aromatiske ring. Som en konsekvens er aromatiske diazoniumsalte mere stabile end alifatiske, da den positive ladning ikke kan delokaliseres langs en carbonkæde (CH2).3, CHtoCH3, etc.).
Artikelindeks
- 1 Træning
- 2 egenskaber
- 2.1 Forskydningsreaktioner
- 2.2 Andre forskydninger
- 2.3 Redoxreaktioner
- 2.4 Fotokemisk nedbrydning
- 2.5 Azo-koblingsreaktioner
- 3 applikationer
- 4 Referencer
Uddannelse
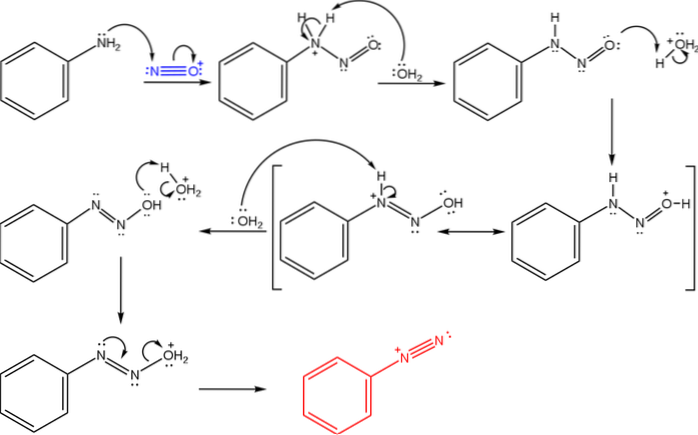
Disse salte er afledt af omsætningen af en primær amin med en syreblanding af natriumnitrit (NaNOto).
Sekundære aminer (RtoNH) og tertiær (R3N) stammer fra andre nitrogenholdige produkter, såsom N-nitrosoaminer (som er gullige olier), aminsalte (R3HN+x-) og N-nitrosoammoniumforbindelser.
Det øverste billede illustrerer den mekanisme, hvormed dannelsen af diazoniumsalte styres, eller også kendt som diazotiseringsreaktionen.
Reaktionen starter med phenylamin (Ar-NHto), som udfører et nukleofilt angreb på N-atomet i nitrosoniumkationen (NO+). Denne kation fremstilles af blandingen NaNOto/ HX, hvor X generelt er Cl; dvs. HCI.
Dannelsen af nitrosonium-kationen frigiver vand i mediet, som fjerner en proton fra det positivt ladede nitrogen..
Derefter det samme vandmolekyle (eller en anden sur art bortset fra H3ELLER+) giver en proton til ilt ved at aflokalisere den positive ladning på det mindre elektronegative nitrogenatom).
Nu deprotonerer vandet kvælstoffet igen og producerer således diazohydroxidmolekylet (det næstsidste i sekvensen).
Da mediet er surt, gennemgår diazohydroxidet dehydrering fra OH-gruppen; for at modvirke elektronisk ledig stilling danner det frie par N tri-bindingen af azogruppen.
Således benzenediazoniumchlorid (C6H5Nto+Cl-, det samme kation fra det første billede).
Ejendomme
Generelt er diazoniumsalte farveløse og krystallinske, opløselige og stabile ved lave temperaturer (mindre end 5 ºC)..
Nogle af disse salte er så følsomme over for mekanisk påvirkning, at enhver fysisk manipulation kan detonere dem. Endelig reagerer de med vand til dannelse af phenoler.
Forskydningsreaktioner
Diazoniumsalte er potentielle frigørere af molekylært kvælstof, hvis dannelse er fællesnævner i fortrængningsreaktioner. I disse fortrænger en art X den ustabile azogruppe og slipper ud som Nto(g).
Sandmeyer-reaktion
ArNto+ + CuCl => ArCl + Nto + Cu+
ArNto+ + CuCN => ArCN + Nto + Cu+
Gatterman-reaktion
ArNto+ + CuX => ArX + Nto + Cu+
I modsætning til Sandmeyer-reaktionen har Gatterman-reaktionen metallisk kobber i stedet for dets halogenid; det vil sige CuX genereres in situ.
Schiemann-reaktion
[ArNto+] BF4- => ArF + BF3 + Nto
Schiemann-reaktionen er karakteriseret ved termisk nedbrydning af benzenediazoniumfluorborat.
Gomberg Bachmann-reaktion
[ArNto+Cl- + C6H6 => Ar - C6H5 + Nto + HCI
Andre forskydninger
ArNto+ + KI => ArI + K+ + Nto
[ArNto+Cl- + H3POto + HtoO => C6H6 + Nto + H3PO3 + HCI
ArNto+ + HtoO => ArOH + Nto + H+
ArNto+ + Frimærketo => ArNOto + Nto + Cu+
Redox reaktioner
Diazoniumsalte kan reduceres til arylhydraziner under anvendelse af en blanding af SnClto/ HCI:
ArNto+ => ArNHNHto
De kan også reduceres til arylaminer ved stærkere reduktioner med Zn / HCI:
ArNto+ => ArNHto + NH4Cl
Fotokemisk nedbrydning
[ArNto+] X- => ArX + Nto
Diazoniumsalte er følsomme over for nedbrydning ved forekomst af ultraviolet stråling eller ved meget tætte bølgelængder.
Azo-koblingsreaktioner
ArNto+ + Ar'H → ArNtoAr '+ H+
Disse reaktioner er måske den mest nyttige og alsidige af diazoniumsaltene. Disse salte er svage elektrofiler (ringen aflokaliserer den positive ladning af azogruppen). For at de kan reagere med aromatiske forbindelser, skal de derefter være negativt ladede, hvilket giver anledning til azosforbindelser..
Reaktionen finder sted med et effektivt udbytte mellem en pH på 5 og 7. Ved sur pH er koblingen lavere, fordi azogruppen er protoneret, hvilket gør det umuligt at angribe den negative ring..
Ligeledes reagerer diazoniumsaltet med basisk pH (større end 10) med OH- til fremstilling af diazohydroxid, som er relativt inert.
Strukturer af denne type organiske forbindelser har et meget stabilt konjugeret Pi-system, hvis elektroner absorberer og udsender stråling i det synlige spektrum..
Derfor er azoforbindelser karakteriseret ved at være farverige. På grund af denne egenskab er de også blevet kaldt azofarvestoffer.
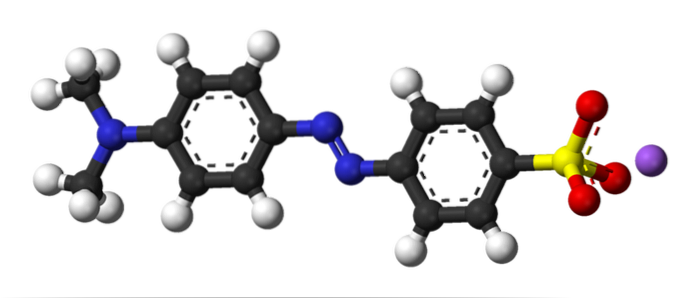
Ovenstående billede illustrerer begrebet azokobling med methylorange som et eksempel. Midt i sin struktur kan azogruppen ses som en forbindelse til de to aromatiske ringe.
Hvilken af de to ringe var elektrofilen i starten af koblingen? Den ene til højre, fordi sulfonatgruppen (-SO3) fjerner elektrondensiteten fra ringen, hvilket gør den endnu mere elektrofil.
Ansøgninger

En af dens mest kommercielle anvendelser er produktionen af farvestoffer og pigmenter, der også omfatter tekstilindustrien til farvning af stoffer. Disse azoforbindelser forankres til specifikke molekylære steder på polymeren og farves i farver.
På grund af dets fotolytiske nedbrydning bruges den (mindre end før) til reproduktion af dokumenter. Hvordan? Områderne på papiret, der er dækket af en speciel plast, fjernes, og derefter påføres en grundlæggende opløsning af phenol, der farve bogstaverne eller designet blå..
I organiske synteser bruges de som udgangspunkt for mange aromatiske derivater.
Endelig har de applikationer inden for smarte materialer. I disse er de kovalent bundet til en overflade (f.eks. Guld), hvilket gør det muligt at give et kemisk respons på eksterne fysiske stimuli..
Referencer
- Wikipedia. (2018). Diazoniumforbindelse. Hentet den 25. april 2018 fra: en.wikipedia.org
- Francis A. Carey. Organisk kemi. Carboxylsyrer. (sjette udgave, side 951-959). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organisk kemi. Aminer. (10. udgave., Side 935-940). Wiley plus.
- Clark J. (2016). Reaktioner af diazoniumsalte. Hentet den 25. april 2018 fra: chemguide.co.uk
- BYJU'S. (5. oktober 2016). Diazoniumsalte og deres anvendelser. Hentet den 25. april 2018 fra: byjus.com
- TheGlobalTutors. (2008-2015). Diazoniumsalte egenskaber. Hentet den 25. april 2018 fra: theglobaltutors.com
- Ahmad et al. (2015). Polymer. Hentet den 25. april 2018 fra: msc.univ-paris-diderot.fr
- CytochromeT. (15. april 2017). Mekanisme til dannelse af benzenediazoniumionen. Hentet den 25. april 2018 fra: commons.wikimedia.org
- Jacques Kagan. (1993). Organisk fotokemi: Principper og applikationer. Academic Press Limited, side 71. Hentet den 25. april 2018 fra: books.google.co.ve

Endnu ingen kommentarer