
Selen historie, egenskaber, struktur, opnåelse, anvendelser
Det selen Det er et ikke-metallisk kemisk element, der hører til gruppe 16 i det periodiske system og er repræsenteret af symbolet Se. Dette element har mellemegenskaber mellem svovl og tellur, som er medlemmer af samme gruppe.
Selen blev opdaget i 1817 af Jöhs J. Berzelius og John G. Gahn, der ved fordampning af pyritten observerede en rød rest (lavere billede). Først forvekslede de det med tellur, men så indså de, at de havde at gøre med et nyt element.

Berzelius navngav det nye element selen, baseret på navnet "selene", der betyder "gudinde af månen." Selen er et essentielt sporstof for planter og dyr, selvom det i høje koncentrationer er et giftigt element.
Selen har tre vigtigste allotropiske former: rød, sort og grå. Sidstnævnte har den egenskab at ændre sin elektriske ledning afhængigt af intensiteten af det lys, der udstråler det (fotoleder), som det har haft mange anvendelser til.
Selen er bredt fordelt i jordskorpen, men de mineraler, der indeholder det, er ikke rigelige, så der er ingen minedrift af selen.
Det opnås hovedsageligt som et biprodukt af raffineringsprocessen med kobberelektrolyse. Selen akkumuleres i siltet, der findes ved anoden af elektrolyseceller.
Mennesker besidder omkring 25 selenoproteiner, hvoraf nogle har en antioxidantvirkning og styrer dannelsen af frie radikaler. Der er også aminosyrer af selen, såsom selenomethionin og selenocystein.
Artikelindeks
- 1 Historie
- 1.1 Første observation
- 1.2 Opdagelse
- 1.3 Oprindelse af hans navn
- 1.4 Udvikling af dine applikationer
- 2 Fysiske og kemiske egenskaber
- 2.1 Udseende
- 2.2 Standard atomvægt
- 2.3 Atomnummer (Z)
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Tæthed
- 2.7 Fusionsvarme
- 2.8 Fordampningsvarme
- 2.9 Molær varmekapacitet
- 2.10 oxidationstal
- 2.11 Elektronegativitet
- 2.12 Ioniseringsenergi
- 2.13 Magnetisk rækkefølge
- 2.14 Hårdhed
- 2.15 Isotoper
- 2.16 Allotropi
- 3 Reaktivitet
- 3.1 Reaktion med hydrogen
- 3.2 Reaktion med ilt
- 3.3 Reaktion med halogener
- 3.4 Reaktion med metaller
- 3.5 Selenitter
- 3.6 Syrer
- 4 Struktur og elektronisk konfiguration
- 4.1 - Selen og dets obligationer
- 4.2 - Ringe eller kæder
- 4.3 - Allotropes
- 5 Hvor finder man og produktion
- 5.1 Elektrolyse af kobber
- 6 Biologisk rolle
- 6.1 Mangel
- 6.2 Enzymkofaktor
- 6.3 Proteiner og aminosyrer
- 7 risici
- 8 anvendelser
- 8.1 Kosmetik
- 8.2 Læger
- 8.3 Elektrolyse af mangan
- 8.4 Pigment
- 8.5 Fotoleder
- 8.6 Krystaller
- 8.7 Vulkanisering
- 8.8 Legeringer
- 8.9 Ensrettere
- 9 Referencer
Historie
Første observation
Alkymisten Arnold de Villanova kan have observeret selen i 1230. Han uddannede sig i medicin på Sorbonne i Paris og var endda læge for pave Klemens V..
Villanova i sin bog Rosarium Philosophorum beskriver et rødt svovl eller "svovl rebeum", der var blevet efterladt i en ovn efter fordampning af svovlet. Dette røde svovl kan have været en allotrop af selen.
Opdagelse
I 1817 opdagede Jöhs Jakob Berzelius og John Gottlieb Gahn selen i et kemisk anlæg til produktion af svovlsyre nær Gripsholm, Sverige. Råmaterialet til fremstilling af syren var pyrit, der blev ekstraheret fra en Falun-mine..
Berzelius blev ramt af eksistensen af en rød rest, der blev tilbage i blybeholderen, efter at svovlet var brændt.
Berzelius og Gahn observerede også, at den røde rest havde en stærk peberrodslugt, der lignede tellur. Derfor skrev han til sin ven Marect, at de mente, at den observerede aflejring var en tellurforbindelse..
Imidlertid fortsatte Berselius med at analysere det deponerede materiale, da pyritten blev forbrændt, og genovervejede, at der ikke var fundet tellur i Falun-minen. Han konkluderede i februar 1818, at han havde opdaget et nyt element.
Navnets oprindelse
Berzelius påpegede, at det nye element var en kombination af svovl og tellur, og at ligheden mellem tellur og det nye element havde givet ham muligheden for at navngive det nye stof selen..
Berzelius forklarede, at "tellus" betyder jordgudinde. Martin Klaport gav i 1799 dette navn til tellurium og skrev: ”Intet enkelt element kaldes det. Det skulle gøres! ".
På grund af ligheden mellem tellur og det nye stof navngav Berzelius det med ordet selen, der stammer fra det græske ord "selene", der betyder "gudinde for månen.".
Udvikling af dine applikationer
I 1873 opdagede Willoughby Smith, at den elektriske ledningsevne af selen var afhængig af det lys, der udstrålede det. Denne egenskab tillod selen at have mange applikationer.
Alexander Graham Bell i 1979 brugte selen i sin fototelefon. Selen producerer en elektrisk strøm, der er proportional med lysets intensitet, der lyser op, og bruges i lysmålere, sikkerhedsmekanismer til åbning og lukning af døre osv..
Brugen af selen-ensrettere i elektronik begyndte i 1930'erne med adskillige kommercielle applikationer. I 1970'erne blev den fortrængt i ensrettere af silicium.
I 1957 blev det opdaget, at selen var et væsentligt element i pattedyrs liv, da det var til stede i enzymer, der beskytter mod reaktivt ilt og frie radikaler. Derudover blev eksistensen af aminosyrer, såsom selenomethionin, opdaget.
Fysiske og kemiske egenskaber
Udseende
Da der er flere allotroper til selen, varierer dets fysiske udseende. Opstår normalt som et rødligt fast stof i pulverform.
Standard atomvægt
78,971 u
Atomnummer (Z)
3. 4
Smeltepunkt
221 ºC
Kogepunkt
685 ºC
Massefylde
Tætheden af selen varierer afhængigt af hvilken allotrop eller polymorf der betragtes. Nogle af dens densiteter bestemt ved stuetemperatur er:
Grå: 4,819 g / cm3
Alfa: 4,39 g / cm3
Glasagtigt: 4,28 g / cm3
Flydende tilstand (smeltepunkt): 3,99 g / cm33
Fusionsvarme
Grå: 6,69 kJ / mol
Fordampningsvarme
95,48 kJ / mol
Molær varmekapacitet
25,363 J / (mol K)
Oxidationsnumre
Selen kan binde i dets forbindelser, der manifesterer følgende tal eller oxidationstilstande: -2, -1, +1, +2, +3, +4, +5, +6. Blandt dem alle er de vigtigste -2 (Seto-), +4 (Se4+) og +6 (Se6+).
For eksempel i SeOto selen har et oxidationsnummer på +4; det vil sige eksistensen af kationen Se antages4+ (Jeg ved4+ELLERtoto-). Tilsvarende med SeO3 selen har et oxidationsnummer på +6 (Se6+ELLER3to-).
I hydrogenselenid, HtoSe, selen har et oxidationsnummer på -2; det vil sige, at eksistensen af ionen eller anionen Se antagesto- (Hto+Jeg vedto-). Dette skyldes, at selen er mere elektronegativ end brint..
Elektronegativitet
2,55 på Pauling-skalaen.
Ioniseringsenergi
-Først: 941 kJ / mol.
-Andet: 2.045 kJ / mol.
-Tredje: 2.973,7 kJ / mol.
Magnetisk rækkefølge
Diamagnetisk.
Hårdhed
2.0 på Mohs-skalaen.
Isotoper
Der er fem naturlige og stabile isotoper af selen, som er vist nedenfor med deres respektive overflader:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropi

Selen fremstillet ved kemiske reaktioner er et murstenrødt amorft pulver, der, når det hurtigt smelter, giver anledning til den glasagtige sorte form, svarende til rosenkransperler (øverste billede). Sort selen er et skørt og blankt fast stof.
Desuden er sort selen let opløselig i carbonsulfid. Når denne opløsning opvarmes til 180 ºC, udfældes grå selen, som er den mest stabile og tætte allotrop..
Gråt selen er modstandsdygtigt over for oxidation og er inaktivt over for virkningen af ikke-oxiderende syrer. Hovedegenskaben ved dette selen er dets fotokonduktivitet. Når den er belyst, stiger dens elektriske ledningsevne med en faktor på 10 til 15 gange.
Reaktivitet
Selen i dets forbindelser findes i oxidationstilstandene -2, +4 og +6. Det viser en klar tendens til at danne syrer i højere oxidationstilstande. Forbindelser, der har selen med oxidationstilstand -2 kaldes selenider (Seto-).
Reaktion med brint
Selen reagerer med hydrogen til dannelse af hydrogenselenid (H.toSe), en farveløs, brandfarlig og illodorøs gas.
Reaktion med ilt
Selens forbrændinger, der udsender en blå flamme og danner selendioxid:
Jeg ved8 (s) + 8 Oto => 8 SeOto (s)
Selenoxid er et fast, hvidt, polymert stof. Dens hydrering producerer selenious syre (HtoSeO3). Også selen danner selentrioxid (SeO3), analog med svovl (SO3).
Reaktion med halogener
Selen reagerer med fluor og danner selenhexafluorid:
Jeg ved8 (s) + 24 F.to (g) => 8 SeF6 (l)
Selen reagerer med chlor og brom for at danne henholdsvis disileniumdichlorid og dibromid:
Jeg ved8 (s) + 4 Clto => 4 SetoClto
Jeg ved8 (s) + 4 Brto => 4 SetoBrto
Selen kan også danne SeF4 og SeCl4.
På den anden side danner selen forbindelser, hvori et selenatom forbinder et af halogen og et andet af ilt. Et vigtigt eksempel er selenoxychlorid (SeOtoClto), med selen i oxidationstilstand +6, et ekstremt kraftigt opløsningsmiddel.
Reaktion med metaller
Selen reagerer med metaller og danner selenider af aluminium, cadmium og natrium. Den kemiske ligning nedenfor svarer til den for dannelsen af aluminiumselenid:
3 Se8 + 16 Al => 8 AltoJeg ved3
Selenitter
Selen danner salte kendt som selenitter; for eksempel: sølvselenit (AgtoSeO3) og natriumselenit (NatoSeO3). Dette navn er blevet brugt i en litterær sammenhæng til at henvise til Månens indbyggere: Selenitterne.
Syrer
Den vigtigste syre i selen er seleninsyre (H.toSeO4). Den er lige så stærk som svovlsyre og reduceres lettere.
Struktur og elektronisk konfiguration
- Selen og dens links
Selen har seks valenselektroner, hvorfor det er placeret i gruppe 16, det samme som ilt og svovl. Disse seks elektroner er i 4s og 4p orbitaler i henhold til deres elektroniske konfiguration:
[Ar] 3d10 4sto 4p4
Det har derfor brug for, som svovl, at danne to kovalente bindinger for at fuldføre sin valensoktet; skønt den har tilgængelighed af sine 4d-orbitaler til at binde sig til mere end to atomer. Således kommer tre selenatomer sammen og danner to kovalente bindinger: Se-Se-Se.
Selen med sin højeste atommasse har en naturlig tendens til at danne strukturer styret af kovalente bindinger; i stedet for at blive arrangeret som diatomiske molekyler Seto, Se = Se, analogt med Oto, O = O.
- Ringe eller kæder
Blandt de molekylære strukturer, som selenatomer anvender, kan to nævnes generelt: ringe eller kæder. Bemærk, at i det hypotetiske tilfælde af Se3, Se-atomerne i enderne kræver stadig elektroner; derfor skal de være bundet til andre atomer efter hinanden, indtil kæden kan lukkes i en ring.
De mest almindelige ringe er de otte-leddede ringe eller atomer af selen:8 (en selenitkrone). Hvorfor otte? Fordi jo mindre ringen er, desto mere stress vil den lide; det vil sige, at vinklerne på deres obligationer afviger fra de naturlige værdier, der er indstillet ved deres SP hybridiseringer3 (ligner det, der forekommer med cycloalkaner).
Da der er otte atomer, er adskillelsen mellem Se-Se-atomerne tilstrækkelig, så deres bindinger "afslappes" og ikke "bøjes"; skønt vinklen på dens led er 105,7 º og ikke 109,5 º. På den anden side kan der være mindre ringe:6 og7.
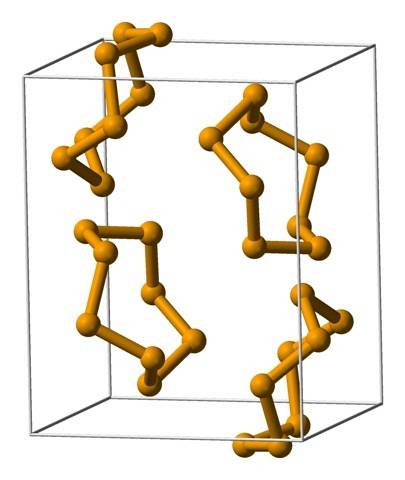
Det øverste billede viser Se ring-enhederne.8. Bemærk den lighed, de har med svovlkronerne; kun de er større og tungere.
Ud over ringe kan selenatomer også arrangeres i spiralformede kæder (tænk spiraltrapper):
I dens ender kan der være terminale dobbeltbindinger (-Se = Se) eller Se-ringe8.
- Allotropes
Under hensyntagen til, at der kan være spiralformede ringe eller kæder af selen, og at deres dimensioner også kan variere afhængigt af antallet af atomer, de indeholder, er det tydeligt, at der er mere end en allotrop for dette element; det vil sige rene selenfaststoffer men med forskellige molekylære strukturer.
Rødt selen
Blandt de mest fremtrædende allotroper af selen har vi rødt, som kan fremstå som et amorft pulver eller som monokliniske og polymorfe krystaller (se billede af Se8).
I amorft rødt selen er strukturerne uordnede uden tilsyneladende mønstre; mens ringene i linsen etablerer en monoklinisk struktur. Rødkrystallinsk selen er polymorf og har tre faser: α, β og γ, som adskiller sig i deres tæthed..
Sort selen
Strukturen af sort selen består også af ringe; men ikke af otte medlemmer, men af mange flere, der når op til ringe med tusind atomer (Se1000). Det siges derefter, at dets struktur er kompleks og består af polymere ringe; nogle større eller mindre end andre.
Da der er polymere ringe i forskellige størrelser, er det vanskeligt at forvente, at de etablerer en strukturel orden; så det sorte selen er også amorft, men i modsætning til det rødlige pulver nævnt ovenfor har det glasagtige teksturer, selvom det er skørt.
Gråt selen
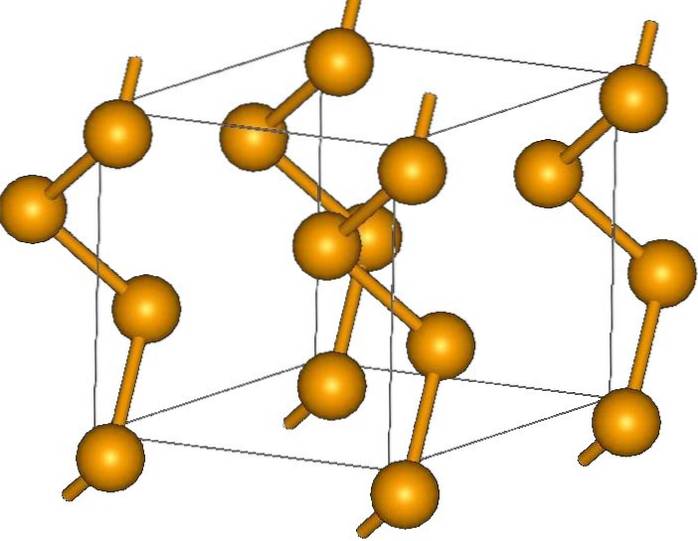
Og endelig er af de mest enkle allotroper af selen grå, som skiller sig ud over de andre, da den er den mest stabile under normale forhold og også har et metallisk udseende..
Dens krystaller kan være sekskantede eller trigonale, etableret af Londons spredningskræfter mellem dets polymere spiralformede kæder (øverste billede). Vinklen på deres bindinger er 130,1 º, hvilket indikerer en positiv afvigelse fra de tetraedriske omgivelser (med vinkler på 109,5 º)..
Derfor giver selen spiralformede kæder indtryk af at være "åbne". I lyset af denne struktur er atomerne vendt mod hinanden, så i teorien skal der være en større overlapning af deres orbitaler for at skabe ledningsbånd.
Varmen med stigningen i de molekylære vibrationer beskadiger disse bånd, når kæderne bliver uordnede; mens en fotones energi direkte påvirker elektronerne, spænder dem og fremmer deres transaktioner. Set fra dette synspunkt er det "let" at forestille sig fotokonduktiviteten for gråt selen..
Hvor det er placeret og produktion
Selvom det er bredt distribueret, er selen et sjældent element. Det findes i sin oprindelige tilstand forbundet med svovl og mineraler såsom eucairite (CuAgSe), claustalite (PbSe), naumanit (AgtoSe) og crookesite [(CuTiAg)toJeg ved].
Selen findes som en urenhed, der erstatter svovl i en lille del af de svovlholdige mineraler af metaller. såsom kobber, bly, sølv osv..
Der er jord, hvor selen findes i den opløselige form af selenater. Disse bæres af regnvandet til floderne og derfra til havet.
Nogle planter er i stand til at absorbere og koncentrere selen. For eksempel indeholder en kop paranødder 544 µg selen, en mængde der svarer til 777% af den daglige anbefalede mængde selen..
Hos levende væsener findes selen i nogle aminosyrer, såsom: selenomethionin, selenocystein og methylselenocystein. Selenocystein og selenit reduceres til hydrogenselenid.
Elektrolyse af kobber
Der er ingen minedrift af selen. Det meste af det opnås som et biprodukt af raffineringsprocessen af kobberelektrolyse, der findes i silt, der akkumuleres ved anoden..
Det første trin er produktionen af selen dioxid. Til dette behandles det anodiske silt med natriumcarbonat for at producere dets oxidation. Derefter tilsættes vand til selenoxid, og det syrnes til dannelse af selensyre..
Endelig behandles selensyre med svovldioxid for at reducere den og opnå elementært selen..
I en anden metode i blandingen af silt og slam dannet ved produktionen af svovlsyre opnås et urent rødt selen, der opløses i svovlsyre..
Selensyre og selensyre dannes derefter. Denne selensyre får samme behandling som den foregående metode.
Klor, der virker på metalselenider, kan også anvendes til at producere flygtige chlorerede selenforbindelser; såsom: SetoClto, SeCl4, SeClto og SeOClto.
Disse forbindelser omdannes i en proces udført i vand til selenious syre, der behandles med svovldioxid for at frigive selen..
Biologisk rolle
Mangel
Selen er et essentielt sporstof for planter og dyr, hvis mangel på mennesker har forårsaget alvorlige lidelser såsom Keshans sygdom; en sygdom karakteriseret ved beskadigelse af myokardiet.
Derudover er selenmangel forbundet med mandlig infertilitet og kan spille en rolle i Kashin-Beck sygdom, en type slidgigt. Der er også observeret selenmangel i reumatoid arthritis.
Enzymkofaktor
Selen er en komponent af enzymer med antioxidant virkning, såsom glutathionperoxidase og thioredoxinreduktase, der virker til at eliminere stoffer med reaktivt ilt..
Derudover er selen en kofaktor for skjoldbruskkirtelhormon deiodinaser. Disse enzymer er vigtige for at regulere funktionen af skjoldbruskkirtelhormoner..
Anvendelse af selen er rapporteret til behandling af Hasimotos sygdom, en autoimmun sygdom med dannelse af antistoffer mod skjoldbruskkirtelceller.
Selen er også blevet brugt til at reducere de toksiske virkninger af kviksølv, da nogle af dets handlinger udøves på selenafhængige antioxidante enzymer.
Proteiner og aminosyrer
Mennesket har ca. 25 selenoproteiner, der udøver en antioxidantvirkning til beskyttelse mod oxidativ stress, initieret af et overskud af reaktive iltarter (ROS) og reaktive nitrogenarter (NOS)..
Tilstedeværelsen af aminosyrerne selenomethiocin og selenocystein er blevet påvist hos mennesker. Selenomethionin bruges som et kosttilskud til behandling af selenmangeltilstande.
Risici
En høj kropskoncentration af selen kan have adskillige skadelige virkninger på helbredet, startende med sprødt hår og sprøde negle, mod hududslæt, varme, ødemer i huden og svær smerte.
Når man behandler selen i kontakt med øjnene, kan folk opleve forbrænding, irritation og rivning. I mellemtiden kan langvarig eksponering for røg med højt selenindhold forårsage lungeødem, hvidløgspust og bronkitis..
Derudover kan personen opleve lungebetændelse, kvalme, kulderystelser, feber, ondt i halsen, diarré og hepatomegali..
Selen kan interagere med andre lægemidler og kosttilskud, såsom antacida, antineoplastiske lægemidler, kortikosteroider, niacin og p-piller..
Selen har været forbundet med en øget risiko for hudkræft. En undersøgelse fra National Cancer Institute viste, at mænd med et højt kropsniveau i selen var dobbelt så tilbøjelige til at lide af aggressiv prostatacancer.
En undersøgelse indikerer, at den daglige indtagelse af 200 µg selen øger muligheden for at udvikle type II-diabetes med 50%.
Ansøgninger
Kosmetik
Selen sulfid anvendes til behandling af seborré såvel som fedtet eller skælhår.
Læger
Det bruges som en alternativ medicin til behandling af Hasimotos sygdom, en autoimmun sygdom i skjoldbruskkirtlen.
Selen reducerer kviksølvets toksicitet, en af dets toksiske aktiviteter udøves på deoxiderende enzymer, der bruger selen som en kofaktor.
Mangan elektrolyse
Anvendelsen af selenoxid til elektrolyse af mangan reducerer omkostningerne ved teknikken betydeligt, da det reducerer elforbruget.
Pigment
Selen bruges som pigment i maling, plast, keramik og glas. Afhængig af det anvendte selen varierer farven på glasset fra dyb rød til lys orange..
Fotokonduktiv
På grund af egenskaberne ved gråt selen til at ændre dets elektriske ledningsevne som en funktion af lysets intensitet, der udstråler det, er selen blevet brugt i kopimaskiner, fotoceller, fotometre og solceller.
Anvendelsen af selen i kopimaskiner var en af de vigtigste anvendelser af selen; men udseendet af organiske fotoledere har været faldende deres anvendelse.
Krystaller
Selen bruges til misfarvning af briller som et resultat af tilstedeværelsen af jern, der giver en grøn eller gul farve. Derudover tillader det en rød farvning af glasset afhængigt af den anvendelse, du vil give det..
Vulkanisering
Diethyldithiocarbonatselen anvendes som et vulkaniseringsmiddel i gummiprodukter.
Legeringer
Selen bruges i kombination med vismut i messing til erstatning af bly; Meget giftigt element, der har været faldende i brug på grund af anbefalinger fra sundhedsorganisationer.
Selen tilsættes i lave koncentrationer til stål og kobberlegeringer for at forbedre anvendelsen af disse metaller..
Ensrettere
Selen ensrettere begyndte at blive brugt i 1933 indtil 1970'erne, da de blev erstattet af silicium på grund af dets lave omkostninger og overlegne kvalitet..
Referencer
- Royal Australian Chemical Institute. (2011). Selen. [PDF]. Gendannet fra: raci.org.au
- Wikipedia. (2019). Selen. Gendannet fra: en.wikipedia.org
- Sato Kentaro. (s.f.). Nye Allotropes af hovedgruppeelementer. [PDF]. Gendannet fra: tcichemicals.com
- Dr. Dough Stewart. (2019). Selen Element Fakta. Chemicool. Gendannet fra: chemicool.com
- Robert C. Brasted. (28. august 2019). Selen. Encyclopædia Britannica. Gendannet fra: britannica.com
- Marques Miguel. (s.f.). Selen. Gendannet fra: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (3. juli 2019). Selen Fakta. Gendannet fra: thoughtco.com
- Lenntech B. V. (2019). Periodisk system: selen. Gendannet fra: lenntech.com
- Tinggi U. (2008). Selen: dets rolle som antioxidant i menneskers sundhed. Miljømæssig sundhed og forebyggende medicin, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Kontor for kosttilskud. (9. juli 2019). Selen: Faktaark for sundhedsprofessionelle. National Institute of Health. Gendannet fra: ods.od.nih.gov


Endnu ingen kommentarer