
Esters egenskaber, struktur, anvendelser, eksempler
Det estere De er organiske forbindelser, der har en carboxylsyrekomponent og en alkoholkomponent. Dens generelle kemiske formel er RCOtoR'' eller RCOOR''. Den højre side, RCOO, svarer til carboxylgruppen, mens den højre side, OR'' det er alkohol. De to deler et iltatom og deler noget lighed med ethere (ROR ').
Af denne grund ethylacetat, CH3COOCHtoCH3, den enkleste af esterne blev den betragtet som den eddikesyre eller eddikeether, og dermed den etymologiske oprindelse af navnet 'ester'. Således består en ester af substitutionen af det sure hydrogen i COOH-gruppen med en alkylgruppe fra en alkohol.

Hvor findes estere? Fra jord til organisk kemi er dens naturlige kilder mange. Den behagelige lugt af frugt, såsom bananer, pærer og æbler, er produktet af esters interaktion med mange andre komponenter. De findes også i form af triglycerider i olier eller fedtstoffer.
Vores krop fremstiller triglycerider fra fedtsyrer, som har lange kulstofkæder, og glycerolalkohol. Hvad der adskiller nogle estere fra andre findes i både R, kæden af syrekomponenten og R ', den for den alkoholiske komponent..
En ester med lav molekylvægt skal have få carbonatomer i R og R ', mens andre, såsom voks, har mange carbonatomer især i R', den alkoholiske komponent, og derfor høje molekylvægte..
Imidlertid er ikke alle estere strengt organiske. Hvis carbonatom i carbonylgruppen erstattes med et af phosphor, har vi RPOOR '. Dette er kendt som en fosfatester, og de er af afgørende betydning i strukturen af DNA..
Så længe et atom effektivt kan binde til carbon eller ilt, såsom svovl (RSOOR '), kan det følgelig danne en uorganisk ester.
Artikelindeks
- 1 egenskaber
- 1.1 Opløselighed i vand
- 1.2 Hydrolysereaktion
- 1.3 Reduktionsreaktion
- 1.4 Transesterificeringsreaktion
- 2 Struktur
- 2.1 Hydrogenbindingsacceptor
- 3 Nomenklatur
- 4 Hvordan dannes de??
- 4.1 Forestring
- 4.2 Estere fra acylchlorider
- 5 anvendelser
- 6 eksempler
- 7 Referencer
Ejendomme
Estere er hverken syrer eller alkoholer, så de opfører sig ikke som sådan. Deres smelte- og kogepunkter er for eksempel lavere end dem med lignende molekylvægt, men tættere på værdierne til aldehyder og ketoner..
Butansyre, CH3CHtoCHtoCOOH, har et kogepunkt på 164 ° C, mens ethylacetat, CH3COOCHtoCH3, på 77,1 ºC.
Bortset fra det nylige eksempel, kogepunkterne for 2-methylbutan, CH3CH (CH3CHtoCH3, af methylacetat, CH3COOCH3, og 2-butanol, CH3,CH (OH) CHtoCH3, de er som følger: 28, 57 og 99 ° C. Alle tre forbindelser har molekylvægte 72 og 74 g / mol..
Estere med lav molekylvægt har tendens til at være flygtige og have behagelige lugte, hvorfor deres indhold i frugt giver dem deres velkendte dufte. På den anden side, når deres molekylvægt er høj, er de farveløse og lugtfri krystallinske faste stoffer eller afhængigt af deres struktur udviser fedtede egenskaber..
Vandopløselighed
Carboxylsyrer og alkoholer er normalt opløselige i vand, medmindre de har en høj hydrofob karakter i deres molekylære strukturer. Det samme gælder for estere. Når R eller R 'er korte kæder, kan esteren interagere med vandmolekyler gennem dipol-dipolkræfter og London-kræfter..
Dette skyldes, at estere er hydrogenbindingsacceptorer. Hvordan? Ved sine to iltatomer RCOOR '. Vandmolekyler danner hydrogenbindinger med nogen af disse oxygener. Men når R- eller R'-kæderne er meget lange, afviser de vandet i deres omgivelser, hvilket gør det umuligt at opløse..
Et indlysende eksempel på dette forekommer med triglyceridestere. Dens sidekæder er lange og gør olier og fedtstoffer uopløselige i vand, medmindre de er i kontakt med et mindre polært opløsningsmiddel, mere beslægtet med disse kæder..
Hydrolysereaktion
Estere kan også reagere med vandmolekyler i det, der er kendt som en hydrolysereaktion. De kræver imidlertid et tilstrækkeligt surt eller basisk medium til at fremme mekanismen for reaktionen:
RCOOR ' + HtoELLER <=> RCOÅh + R'OH
(Syremedium)
Vandmolekylet tilføjes til carbonylgruppen, C = O. Syrehydrolyse er opsummeret i substitutionen af hver R 'af den alkoholiske komponent med en OH fra vand. Bemærk også, hvordan esteren "bryder" ind i sine to komponenter: carboxylsyren, RCOOH og alkoholen R'OH..
RCOOR ' + Åh- => RCOELLER- + R'OH
(Grundlæggende medium)
Når hydrolyse udføres i et basisk medium, forekommer en irreversibel reaktion kendt som forsæbning. Dette er meget udbredt og er hjørnestenen i produktionen af håndværksmæssige eller industrielle sæber..
RCOO- er den stabile carboxylatanion, der associeres elektrostatisk med den dominerende kation i mediet.
Hvis den anvendte base er NaOH, dannes RCOONa-saltet. Når esteren er et triglycerid, der pr. Definition har tre R-sidekæder, dannes der tre fedtsyresalte, RCOONa og alkoholglycerolen.
Reduktionsreaktion
Estere er stærkt oxiderede forbindelser. Hvad betyder det? Det betyder, at det har flere kovalente bindinger med ilt. Ved at eliminere C-O-bindingerne opstår der et brud, der ender med at adskille de sure og alkoholiske komponenter; Desuden reduceres syren til en mindre oxideret form til en alkohol:
RCOOR '=> RCHtoOH + R'OH
Dette er reduktionsreaktionen. Der kræves et stærkt reduktionsmiddel, såsom lithiumaluminiumhydrid, LiAlH4, og fra et surt medium, der fremmer migration af elektroner. Alkoholer er de mindste former, det vil sige dem med de mindst kovalente bindinger med ilt (kun en: C-OH).
De to alkoholer, RCHtoOH + R'OH, kommer fra de to respektive kæder af den originale RCOOR 'ester. Dette er en metode til syntese af værditilførte alkoholer fra deres estere. For eksempel, hvis du ønskede at fremstille en alkohol fra en eksotisk kilde til estere, ville dette være en god rute til dette formål..
Transesterificeringsreaktion
Estere kan omdannes til andre, hvis de reagerer i sure eller basiske omgivelser med alkoholer:
RCOOR ' + R "OH <=> RCOELLER " + R'OH
Struktur
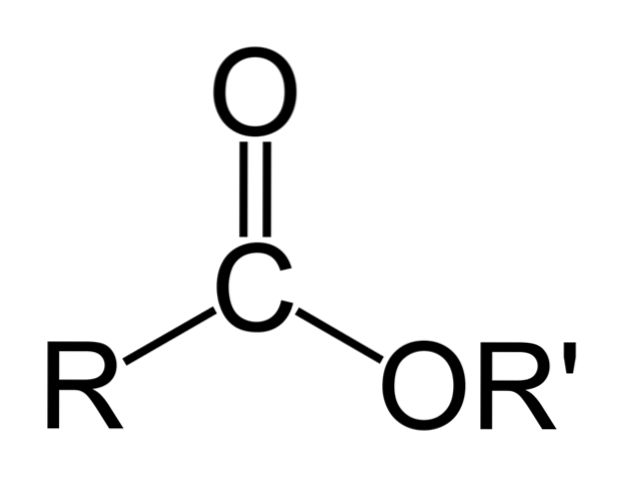
Det øverste billede repræsenterer den generelle struktur for alle organiske estere. Bemærk, at R, carbonylgruppen C = O og OR ', danner en flad trekant, produkt af sp-hybridiseringto af det centrale kulstofatom. Imidlertid kan de andre atomer vedtage andre geometrier, og deres strukturer afhænger af den iboende natur af R eller R '.
Hvis R eller R 'er enkle alkylkæder, for eksempel af typen (CHto)nCH3, disse vises zigzagget i rummet. Dette er tilfældet med Pentyl Butanoate, CH3CHtoCHtoCOOCHtoCHtoCHtoCHtoCH3.
Men i et hvilket som helst af kulstofferne i disse kæder kunne der findes en forgrening eller umættethed (C = C, C2C), som ville modificere esterens globale struktur. Og af denne grund varierer dets fysiske egenskaber, såsom opløselighed og dets kogepunkter og smeltepunkter, med hver forbindelse..
For eksempel har umættede fedtstoffer dobbeltbindinger i deres R-kæder, som påvirker intermolekylære interaktioner negativt. Som et resultat falder deres smeltepunkter, indtil de er flydende eller olier ved stuetemperatur..
Hydrogenbindingsacceptor
Selvom esterskeletets trekant skiller sig mere ud i billedet, er det R- og R'-kæderne, der er ansvarlige for mangfoldigheden i deres strukturer..
Imidlertid fortjener trekanten en strukturel egenskab ved estere: de er hydrogenbindingsacceptorer. Hvordan? Gennem ilt fra carbonyl- og alkoxidgrupperne (-OR ').
Disse har par frie elektroner, som kan tiltrække delvist positive ladede hydrogenatomer fra vandmolekyler..
Derfor er det en særlig type dipol-dipol-interaktioner. Vandmolekylerne nærmer sig esteren (hvis de ikke forhindres af R- eller R'-kæderne) og C = O-H-broerne dannestoO eller OHto-O-R '.
Nomenklatur
Hvordan navngives estere? For korrekt navngivning af en ester er det nødvendigt at tage højde for carbonantalet i R- og R'-kæderne. Ligeledes enhver mulig forgrening, substituent eller umættethed.
Når først dette er gjort, tilføjes suffikset -yl til navnet på hver R 'af alkoxidgruppen -OR', mens til kæden R af carboxylgruppen -COOR er suffikset -atet. Afsnit R nævnes først efterfulgt af ordet 'af' og derefter navnet på sektion R '.
For eksempel CH3CHtoCHtoCOOCHtoCHtoCHtoCHtoCH3 Den har fem carbonatomer på højre side, dvs. de svarer til R '. Og på venstre side er der fire carbonatomer (inklusive carbonylgruppen C = O). Derfor er R 'en pentylgruppe og R en butan (for at inkludere carbonyl og betragte hovedkæden).
Så for at navngive forbindelsen skal du blot tilføje de tilsvarende suffikser og navngive dem i den rigtige rækkefølge: butanbundet af pentilo.
Sådan navngives følgende forbindelse: CH3CHtoCOOC (CH3)3? Strengen -C (CH3)3 svarer til tert-butylalkylsubstituenten. Da venstre side har tre carbonatomer, er det en "propan". Dens navn er så: propanbundet af tert-butilo.
Hvordan dannes de?
Forestring
Der er mange ruter til at syntetisere ester, hvoraf nogle endda kan være nye. Imidlertid konvergerer de alle sammen med det faktum, at trekanten i billedet af strukturen skal dannes, det vil sige CO-O-bindingen. Til dette skal du starte fra en forbindelse, der tidligere har carbonylgruppen: såsom en carboxylsyre.
Og hvad skal carboxylsyre binde til? Til en alkohol, ellers ville den ikke have den alkoholiske komponent, der karakteriserer estere. Carboxylsyrer kræver imidlertid varme og surhed for at lade reaktionsmekanismen fortsætte. Den følgende kemiske ligning repræsenterer ovenstående nævnte:
RCOOH + R'OH <=> RCOOR '+ HtoELLER
(Syremedium)
Dette er kendt som forestring.
F.eks. Kan fedtsyrer forestres med methanol, CH3OH, for at erstatte dets sure H med methylgrupper, så denne reaktion kan også betragtes som methylering. Dette er et vigtigt skridt til bestemmelse af fedtsyreprofilen for visse olier eller fedtstoffer..
Estere fra acylchlorider
En anden måde at syntetisere estere på er fra acylchlorider, RCOCl. I stedet for at erstatte en OH-hydroxylgruppe er Cl-atomet substitueret:
RCOCl + R'OH => RCOOR '+ HCI
Og i modsætning til forestring af en carboxylsyre frigøres ikke vand, men saltsyre.
Andre metoder er tilgængelige inden for den organiske kemis verden, såsom Baeyer-Villiger-oxidationen, der bruger peroxysyrer (RCOOOH)..
Ansøgninger

Blandt de vigtigste anvendelser af estere er:
-Ved fremstilling af stearinlys eller tilspidsninger, som den på billedet ovenfor. Meget lange sidekædestere anvendes til dette formål..
-Som konserveringsmiddel for medicin eller fødevarer. Dette skyldes virkningen af parabener, som ikke er andet end estere af para-hydroxybenzoesyre. Selvom de bevarer produktets kvalitet, er der undersøgelser, der sætter spørgsmålstegn ved dets positive virkning på kroppen.
-De bruges til fremstilling af kunstige dufte, der efterligner lugten og smagen af mange frugter eller blomster. Således er estere til stede i slik, is, parfume, kosmetik, sæbe, shampoo blandt andre kommercielle produkter, der fortjener attraktive aromaer eller smag..
-Estere kan også have en positiv farmakologisk virkning. Af denne grund har lægemiddelindustrien dedikeret sig til at syntetisere estere afledt af syrer, der er til stede i kroppen for at evaluere enhver mulig forbedring i behandlingen af sygdomme. Aspirin er et af de enkleste eksempler på disse estere.
-Flydende estere, såsom ethylacetat, er egnede opløsningsmidler til visse typer polymerer, såsom nitrocellulose og en bred vifte af harpikser.
Eksempler
Nogle yderligere eksempler på estere er som følger:
-Pentylbutanoat, CH3CHtoCHtoCOOCHtoCHtoCHtoCHtoCH3, der lugter af abrikos og pærer.
-Vinylacetat, CH3COOCHto= CHto, hvorfra der fremstilles polyvinylacetatpolymer.
-Isopentylpentanoat, CH3CHtoCHtoCHtoCOOCHtoCHtoCH (CH3)to, som efterligner smagen af æbler.
-Ethylpropanoat, CH3CHtoCOOCHtoCH3.
-Propylmethanoat, HCOOCHtoCHtoCH3.
Referencer
- T.W. Graham Solomons, Craigh B. Fryhle. Organisk kemi. (Tiende udgave, s 797-802, 820) Wiley Plus.
- Carey, F. A. Organic Chemistry (2006) Sjette udgave. Mc Graw Hill Publishing House-
- Kemi LibreTexts. Esters nomenklatur. Gendannet fra: chem.libretexts.org
- Administrator. (2015, 19. september). Estere: Dens kemiske natur, egenskaber og anvendelser. Hentet fra: pure-chemical.com
- Organisk kemi i vores daglige liv. (9. marts 2014). Hvad er brugen af estere? Gendannet fra: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Eksempler på estere. Gendannet fra: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Esters vigtigste anvendelser. Hentet fra: uaeh.edu.mx
- Jim Clark. (Januar 2016). Introduktion til estere. Hentet fra: chemguide.co.uk


Endnu ingen kommentarer