
Kaliumsulfat (K2SO4) struktur, egenskaber, anvendelser, syntese

Det kaliumsulfat er et hvidt eller farveløst uorganisk salt, hvis kemiske formel er KtoSW4. Det var allerede kendt i det fjortende århundrede og blev i det syttende århundrede kaldt salt duplicatum, da det er en kombination af et syresalt og et alkalisk salt..
Kaliumsulfat findes i mineralsk form i arcanit, men dets præsentation er mere almindelig i de såkaldte Stassfurt-salte. Disse er samkrystallisationer af kalium, magnesium, calcium og natriumsulfater, der kan observeres i mineraler såsom leonit og polyhalit..

Kaliumsulfat er et lavtoksisk salt og forårsager kun irritation ved kontakt med øjnene, luftvejene eller fordøjelseskanalen. Der er ingen tegn på kræftfremkaldende eller mutagen virkning.
Kaliumsulfat anvendes som gødning, især i afgrøder, der er modtagelige for klorider; sådan er tilfældet med tobak og kartofler. Forbindelsen tilvejebringer kalium, et af de tre vigtigste næringsstoffer i planter, og svovl, der er til stede i deres proteiner..
Artikelindeks
- 1 Struktur
- 1.1 Krystallinske faser
- 1.2 ionflok
- 2 Fysiske og kemiske egenskaber
- 2.1 Navne
- 2.2 Molær masse
- 2.3 Fysisk udseende
- 2.4 Tæthed
- 2.5 Smeltepunkt
- 2.6 Kogepunkt
- 2.7 Opløselighed i vand
- 2.8 Opløselighed i organiske opløsningsmidler
- 2.9 Brydningsindeks (nD)
- 2.10 Reaktivitet
- 3 Syntese
- 3.1 Første metode
- 3.2 Anden metode
- 3.3 Tredje metode
- 3.4 Fjerde metode
- 4 anvendelser
- 4.1 Gødning
- 4.2 Industriel anvendelse og som råmateriale
- 4.3 Medicin
- 4.4 Veterinær
- 4.5 Madaroma
- 4.6 Andre anvendelser
- 5 risici
- 6 Referencer
Struktur
Krystallinske faser
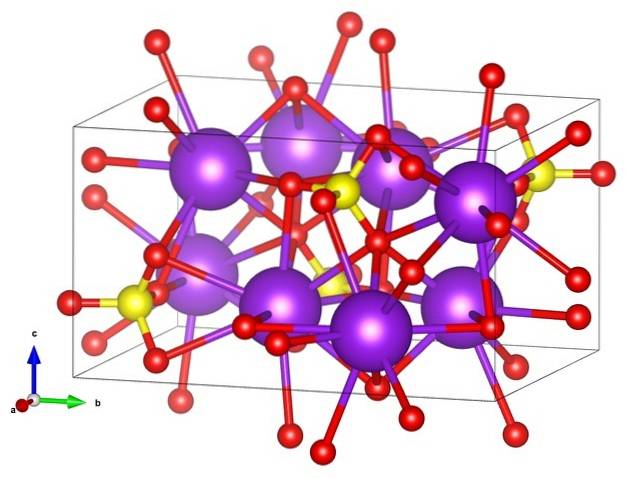
På det første billede blev strukturformlen af kaliumsulfat vist. For hver SO-anion4to-, af tetrahedral geometri er der to kationer K+, som kan repræsenteres af lilla kugler (øverste billede).
Således har vi den orthorhombiske krystalstruktur af KtoSW4, med SO anioner4to- repræsenteret af gule og røde kugler; mens K-kationerne+, allerede sagt, de er de lilla kugler (lidt mere robuste).
Denne repræsentation kan forårsage forvirring, hvis du mener, at bjælkerne virkelig svarer til koordinationslinks. Snarere angiver de, hvilken ion der interagerer direkte eller tæt med en anden omkring den. Derfor "forbinder" hvert ilt med fem K+ (ELLER3SWto-- K+), og disse igen med ti oxygener fra andre omgivende sulfatanioner.
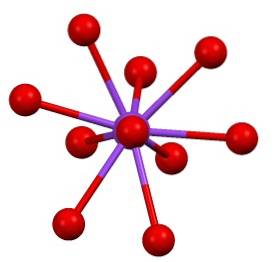
Der er så en noget "sjælden" koordinationssfære for kalium i KtoSW4:
Denne krystallinske struktur svarer til polymorf β-KtoSW4. Ved opvarmning til 583 ºC opstår der en overgang til α-K-fasentoSW4, som er sekskantet.
Ion vikling
Bestemt strukturen af KtoSW4 det er usædvanligt kompliceret for et uorganisk salt. Dens ioner er positioneret og danner en slags meningsløs flok og mangler periodicitet for det blotte øje.
De, der dedikerer sig til krystallografi, kan nærme sig dette virvar på en mere passende og beskrivende måde og observere det fra de tre rumlige akser.
Bemærk, at dens sammenfiltrede struktur kunne forklare, hvorfor KtoSW4 danner ikke hydrater: H-molekylertoEller de har ingen måde at trænge igennem krystalgitteret for at hydrere kaliumkationer.
Også med så mange interaktioner, der er omfattet af ionflirken, kan det forventes, at dette krystalgitter vil have en ret stabilitet mod varme; og faktisk er dette tilfældet, da smeltepunktet for KtoSW4 er 1.069 ºC, hvilket viser, at dets ioner er stærkt sammenhængende.
Fysiske og kemiske egenskaber

Navne
-Kaliumsulfat
-Sulfat af kaliumchlorid
-Arcanite
-Svovl kaliumchlorid
Molar masse
174,259 g / mol
Fysisk fremtoning
Hvidt, lugtfri, bittert smagende krystalfast, granulat eller pulver.
Massefylde
2,66 g / cm3
Smeltepunkt
1.069 ºC
Kogepunkt
1.689 ºC
Vandopløselighed
111 g / L ved 20 ºC
120 g / L ved 25 ºC
240 g / L ved 100 ºC
Opløseligheden i vand falder på grund af tilstedeværelsen af kaliumchlorid, KCl eller ammoniumsulfat (NH4)toSW4, på grund af den fælles ioneffekt.
Opløselighed i organiske opløsningsmidler
Let opløselig i glycerol, men uopløselig i acetone og carbonsulfid.
Brydningsindeks (nD)
1.495
Reaktivitet
Kaliumsulfat kan reagere med svovlsyre, forsuring til dannelse af kaliumbisulfat (KHSO4). Det kan reduceres ved høje temperaturer til kaliumsulfid (KtoS).
Syntese
Første metode
Kaliumsulfat syntetiseres ved omsætning af kaliumchlorid med svovlsyre. Syntesen af kaliumsulfat sker i to trin. Det første trin involverer dannelsen af kaliumbisulfat.
Dette er en eksoterm reaktion, da den frigiver varme og derfor ikke kræver en ekstern varmeforsyning. Reaktionen udføres ved stuetemperatur.
KCl + HtoSW4 => HCI + KHSO4
Det andet trin i reaktionen er endoterm, det vil sige, det kræver tilførsel af varme, så den kan forekomme.
KCl + KHSO4 => HCI + KtoSW4
Anden metode
Kaliumsulfat kan syntetiseres ved neutraliseringsreaktion af svovlsyre med en base, kaliumhydroxid:
HtoSW4 + 2 KOH => KtoSW4 + 2 timertoELLER
Tredje metode
Kaliumsulfat produceres ved omsætning af svovldioxid, ilt, kaliumchlorid og vand.
Fjerde metode
Kaliumsulfat produceres ved at ekstrahere kaliumsulfat til stede i en saltvand fra Loop Nur-bassinet, Kina. Kaliumsulfat separeres fra de uopløselige komponenter i saltopløsningen ved tilsætning af den forsurende forbindelse natriumtripolyphosphat / urinstofosfat.
Denne forbindelse øger forskellen mellem opløseligheden af kaliumsulfat og opløseligheden af de andre mindre opløselige forbindelser og opnår ifølge skaberne af metoden et 100% rent kaliumsulfat. I streng forstand er det ikke en syntesemetode, men det er en ny ekstraktionsmetode.
Ansøgninger
Gødning

Anvendelsen af kaliumsulfat som gødning er dens vigtigste anvendelse. 90% af dets samlede produktion bruges til dette formål. Dens anvendelse foretrækkes frem for kaliumchlorid i de afgrøder, der er følsomme over for tilstedeværelsen af chlorid i jorden; for eksempel tobak.
Kaliumsulfat har et kaliumindhold på 40-44%, mens dets svovlkoncentration udgør 17-18% af forbindelsen. Kalium er nødvendigt for at udføre mange vigtige funktioner for planter, da det aktiverer enzymatiske reaktioner, proteinsyntese, stivelsesdannelse osv..
Derudover er kalium involveret i reguleringen af vandstrømmen i bladene. Svovl er nødvendigt til proteinsyntese, da det er til stede i aminosyrer, der har det; sådan er tilfældet med methionin, cystein og cystin, og det griber også ind i enzymatiske reaktioner.
Selv kaliumsulfat anvendes ved sprøjtning på bladene i kaliumsulfatpartikler mindre end 0,015 mm.
Industriel anvendelse og som råmateriale
Rå kaliumsulfat anvendes til fremstilling af glas og til fremstilling af alun og kaliumcarbonat. Det bruges som et reagens til fremstilling af kosmetik. Det bruges til fremstilling af øl som vandkorrektionsmiddel.
Medicin
Det bruges til at korrigere et alvorligt fald i plasmakaliumkoncentrationen (hypokalæmi) forårsaget af overdreven brug af diuretika, der øger udskillelsen af kalium i urinen..
Kalium er den vigtigste intracellulære ion af exciterende celler, herunder hjerteceller. Derfor nedsætter et alvorligt fald i kalium i plasma hjertefunktionen og skal rettes straks..
Kaliumsulfat har en katartisk virkning, det vil sige, det favoriserer udvisning af afføring fra tyktarmen. Af denne grund anvendes en blanding af kalium, magnesium og natriumsulfater til at rense tyktarmen for afføring, før der udføres en koloskopi, hvilket muliggør en bedre visualisering af tyktarmen af lægen..
dyrlæge
Kaliumsulfat er blevet brugt til at mindske methioninbehovet i fjerkræfoder. Tilstedeværelsen af 0,1% kaliumsulfat i æglæggende hønsfoder er forbundet med en 5% stigning i ægproduktionen.
Mad aroma
Det er et smagsstof, der giver fødevarer en bitter og salt smag, der er ønskelig i nogle af dem. Derudover bemærkes det, at kaliumsulfat er udstyret med de fire basale smagsstoffer: sødme, bitterhed, syre og saltholdighed..
Saltholdighed, surhed og bitterhed øges med koncentrationen af kaliumsulfat, mens sødme aftager.
Andre anvendelser
Kaliumsulfat anvendes som et pyroteknisk middel i kombination med kaliumnitrat til at generere en lilla flamme. Anvendes som en flashreduktor i artilleri thruster afgifter.
Derudover bruges det som et viskositetsforøgende middel i kosmetiske produkter såsom ansigtscremer..
Risici
Kaliumsulfat er en lavtoksisk forbindelse med en meget lav dødelighed. LD50 for den orale dosis hos mus er 6.600 mg / kg dyrevægt, hvilket indikerer, at der kræves en høj dosis for at forårsage musedød. Den samme LD50-værdi forekommer hos rotter.
I øjnene kan kaliumsulfat forårsage mekanisk irritation ved kontakt. På huden forårsager kaliumsulfat ringe skade på industriel håndtering..
Ved indtagelse kan kaliumsulfat forårsage gastrointestinal irritation med kvalme, opkastning og diarré. Og endelig forårsager indånding af kaliumsulfatstøv irritation i luftvejene..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Kaliumsulfat. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Kaliumsulfat. PubChem-database. CID = 24507. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Brian Clegg. (5. juli 2018). Kaliumsulfat. Royal Society of Chemistry. Gendannet fra: chemistryworld.com
- Marie T. Averbuch-Pouchot, A. Durif. (nitten seksoghalvfems). Emner i fosfatkemi. Verdensvidenskabelige. Gendannet fra: books.google.co.ve
- Kemikaliebog. (2017). Kaliumsulfat. Gendannet fra: chemicalbook.com
- Shoujiang L. et al. (2019). Oprensning og hurtig opløsning af kaliumsulfat i vandige opløsninger. DOI: 10.1039 / C8RA08284G
- DrugBank. (2019). Kaliumsulfat. Gendannet fra: drugbank.ca
- Mosaikfirmaet. (2019). Kaliumsulfat. Crop Nutrition. Gendannet fra: cropnutrition.com
- Narkotika. (2018). Natriumsulfat, kaliumsulfat og magnesiumsulfat (oral). Gendannet fra: drugs.com



Endnu ingen kommentarer