
Natriumsulfat (Na2SO4) struktur, egenskaber, anvendelser, produktion

Det natriumsulfat er et uorganisk salt, hvis kemiske formel er NatoSW4. Det består af et hvidt fast stof, der er til stede i tre former: vandfri, heptahydratet (næppe tilgængeligt) og decahydratet (som er kendt som Glauberts salt); sidstnævnte er den mest almindelige form for natriumsulfat.
Natriumsulfat-decahydrat, NatoSW410HtoEller det blev opdaget i 1625 af Glaubert i vandet i en kilde, der kaldte det sal mirabilis (mirakuløst salt) på grund af dets medicinske egenskaber.

Natriumsulfat har mange anvendelser inden for tekstil- og papirindustrien såvel som til fremstilling af glas. Dens anvendelser udvides til at omfatte termiske applikationer, som inkluderer omgivende varmeforsyning og bærbar køling..
Natriumsulfat er en lavtoksicitetsforbindelse, og dets skadelige virkninger er hovedsageligt mekaniske og ikke-kemiske. Af krystallografiske årsager har dette salt, ligesom dets kaliummodstykke, KtoSW4, har gitter og polymorfe strukturer.
Artikelindeks
- 1 Struktur
- 1.1 Vandfrit salt
- 1.2 Dekahydrateret salt
- 2 egenskaber
- 2.1 Navne
- 2.2 Molær masse
- 2.3 Fysisk udseende
- 2.4 Lugt
- 2.5 Smag
- 2.6 Tæthed
- 2.7 Smeltepunkt
- 2.8 Kogepunkt
- 2.9 Opløselighed i vand
- 2.10 Brydningsindeks
- 2.11 Stabilitet
- 2.12 Nedbrydning
- 2,13 pH
- 2.14 Reaktivitet
- 3 anvendelser
- 3.1 Papirindustri
- 3.2 Vaskemidler
- 3.3 Briller
- 3.4 Tekstilindustrien
- 3.5 Medicin
- 3.6 Tørringsmiddel
- 3.7 Råmateriale
- 4 Opnåelse
- 4.1 Udvinding af minedrift
- 4.2 Kemisk produktion
- 5 risici
- 6 Referencer
Struktur
Vandfrit salt
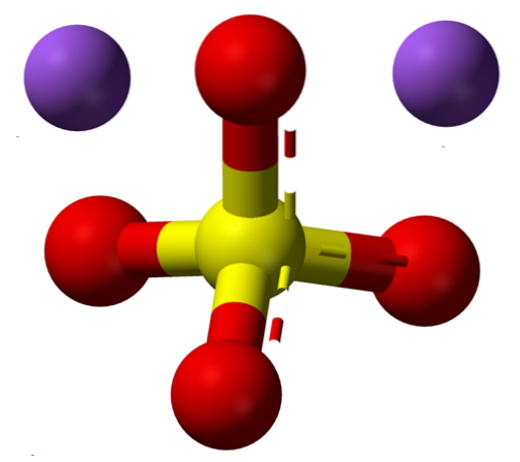
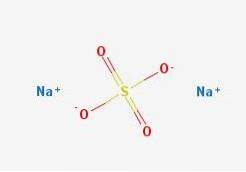
Formlen NatoSW4 angiver straks, at Na-ionerne i saltkrystallerne+ Også4to- de er i forholdet 1: 2; det vil sige for hver anden Na-kation+ der er en anion SO4to- interagerer med dem gennem elektrostatisk tiltrækning (øverste billede).
Selvfølgelig gælder dette for NatoSW4 vandfri, ingen vandmolekyler koordineret med natrium i krystallerne.
På trods af at det er et tilsyneladende simpelt salt, er beskrivelsen strukturelt kompleks. NatoSW4 præsenterer polymorfisme med op til fem krystallinske faser: I, II, III, IV og V, hvis overgangstemperaturer er henholdsvis 180, 200, 228, 235 og 883 ºC.
Selvom der ikke er nogen referencer til at certificere det, er NatoSW4Jeg må være den med en sekskantet krystallinsk struktur, tættere sammenlignet med den orthorhombiske NatoSW4III, i hvis krystaller Na+ danne tetraeder (NaO4) og octahedra (NaO6) koordinering det vil sige, det kan være omgivet af fire eller seks anioner SÅ4to-.
Dekahydrateret salt
I mellemtiden er den monokliniske krystalstruktur af dets vigtigste hydrat, NatoSW410HtoEller det er enklere. I det er det praktisk taget vandmolekylerne, der interagerer eller koordinerer med Na+ i oktaedra Na (HtoELLER)6+, med SO4to- bare give tilstrækkelig stabilitet til krystallen, så den eksisterer i den faste fase.
Dets smeltepunkt (32,38 ºC) er meget lavere end det vandfri salt (884 ºC) viser, hvordan vandmolekyler og deres hydrogenbindinger svækker de stærkere ioniske interaktioner i NatoSW4.
Ejendomme
Navne
-Natriumsulfat (IUPAC)
-Glaubers salt (decahydrat)
-Mirakuløst salt (decahydrat)
-Dinatriumsulfat.
Molar masse
142,04 g / mol (vandfri)
322,20 g / mol (decahydrat)
Fysisk fremtoning
Hvidt hygroskopisk krystallinsk fast stof
Lugt
Toilet
Smag
Bitter og salt
Massefylde
2.664 g / cm3 (vandfri)
1.464 g / cm3 (decahydrat)
Læg mærke til, hvordan vandmolekylerne inde i krystallerne får dem til at ekspandere og derfor mindsker deres tæthed..
Smeltepunkt
884 ºC (vandfri)
32,38 ºC (decahydrat)
Kogepunkt
1.429 ºC (vandfri)
Vandopløselighed
4,76 g / 100 ml (0 ºC)
13,9 g / 100 ml (20 ° C)
42,7 g / 100 ml (100 ° C)
Alle opløselighedsværdier svarer til det vandfri salt, som er ret opløseligt i vand ved alle temperaturer..
Opløseligheden stiger brat mellem 0 ° C og 38,34 ° C, idet det observeres, at opløseligheden i dette temperaturområde stiger mere end 10 gange. Fra 32,38 ºC er opløseligheden imidlertid uafhængig af temperaturen..
Det sker, at natriumsulfat-decahydratet ved en temperatur på 32,8 ºC opløses i sit eget krystallinske vand. Der opnås således en ligevægt mellem decahydratsaltet, det vandfrie salt og den mættede opløsning af natriumsulfat..
Så længe trefasetilstanden opretholdes, forbliver temperaturen konstant, hvilket gør det muligt at kalibrere temperaturen på termometrene.
På den anden side er opløselighederne for det heptahydrerede salt:
19,5 g / 100 ml (0 ºC)
44,0 g / 100 ml (20 ° C)
Bemærk, at det heptahydrerede salt ved 20 ° C er tre gange mere opløseligt end det vandfrie..
Brydningsindeks
1.468 (vandfri)
1,394 (decahydrat)
Stabilitet
Stabil under anbefalede opbevaringsforhold. Uforenelig med stærke syrer og baser, aluminium og magnesium.
Nedbrydning
Når det opvarmes til nedbrydning, udsender det en giftig røg af svovloxid og natriumoxid..
pH
En 5% vandig opløsning har en pH-værdi på 7.
Reaktivitet
Natriumsulfat dissocieres i vandig opløsning i 2 Na+ Også4to-, som tillader sulfationen at kombinere med Bato+ at udfælde bariumsulfat. Hjælper praktisk talt med at fortrænge bariumioner fra vandprøver.
Natriumsulfat omdannes til natriumsulfid ved omsætning ved forhøjede temperaturer med kul:
NatoSW4 + 2 C => NatoS + 2 COto
Glauberts salt, NaSO4.10HtoEller reagerer med kaliumcarbonat for at producere natriumcarbonat.
Ansøgninger
Papirindustrien
Natriumsulfat anvendes til fremstilling af papirmasse. Det bruges i produktionen af kraftpapir, der ikke indeholder lignin eller udsættes for blegeprocessen, hvilket giver det stor modstand. Derudover bruges det til fremstilling af pap.
Vaskemidler
Anvendes som fyldstof til syntetiske rengøringsmidler, der tilsættes vaskemiddel for at reducere overfladespændingen.
Briller
Det bruges i glasfremstilling til at reducere eller eliminere tilstedeværelsen af små luftbobler i smeltet glas. Derudover eliminerer det dannelsen af slagge under raffineringsprocessen af det smeltede glas.
Tekstilindustri
Natriumsulfat bruges som en mordant, da det letter interaktionen mellem farvestoffer og fibrene i stoffer. Natriumsulfatdecahydrat anvendes i farvestofprøven.
Derudover anvendes natriumsulfat som et farvestoffortyndingsmiddel og farvestof-hjælpestof; såsom direkte farvestoffer, svovlfarvestoffer og andre stoffer, der fremmer bomuldsfarvning. Det bruges også som et hæmmende middel til direkte silkefarvestoffer.
Medicin
Natriumsulfatdecahydrat bruges som afføringsmiddel, da det absorberes dårligt i tarmen og derfor forbliver i tarmens lumen, hvilket forårsager en stigning i volumen. Dette stimulerer stigningen i peristaltiske sammentrækninger, som inducerer udvisning af tarmindhold..
Natriumsulfat er en modgift til bekæmpelse af barium og blysaltforgiftning. Glauberts salt er effektivt til eliminering af visse overdrevent indtagne lægemidler; for eksempel paracetamol (acetoaminophen).
Derudover bruges det til at levere mangelfuld elektrolytter til stede i isoosmotic opløsninger..
Tørringsmiddel
Natriumsulfat, der er et inaktivt reagens, bruges til at fjerne vand fra opløsninger af organiske forbindelser..
Råmateriale
Natriumsulfat anvendes som råmateriale til produktion af adskillige stoffer, herunder: natriumsulfid, natriumcarbonat og ammoniumsulfat.
Opnåelse
Natriumsulfat opnås ved udvinding af minedrift og ved kemiske reaktioner.
Udvinding af minedrift
Der er tre malme eller mineraler, der udnyttes med kommercielt udbytte: thenardit (NatoSW4), mirabilitten (NatoSW410HtoO) og glaubarit (NatoSW4·Sag4).
I Spanien udnyttes aflejringerne af danardit og mirabilit ved underjordisk minedrift af gallerier og søjler. I mellemtiden opnås glauberitten i det fri ved hjælp af store flåder, der placeres på mineralaflejringen.
Landet forberedes med sprængning med lav intensitet for at frembringe en porøsitet, der tillader udvaskning af natriumsulfat. Produktionsfasen sker med sprinklervanding med ferskvand af glauberitten, hvis udvaskning spredes nedad..
Natriumsulfat-saltopløsningen opsamles, hvorved calciumsulfatresten efterlades som fyldning..
Kemisk produktion
Natriumsulfat opnås under produktionen af saltsyre ved to processer: Mannheim-processen og Hardgreaves-processen.
Mannheim-processen
Det udføres i store stålovne og med en 6 m stålreaktionsplatform. Reaktionen sker mellem natriumchlorid og svovlsyre:
2 NaCl + HtoSW4 => 2 HCI + NatoSW4
Hardgreaves proces
Det involverer reaktionen mellem natriumchlorid, svovloxid, ilt og vand:
4 NaCl + 2 SOto + ELLERto + 2 timertoO => 4 HCI + NatoSW4
Andre
Natriumsulfat produceres i neutraliseringsreaktionen mellem natriumhydroxid og svovlsyre:
2 NaOH + HtoSW4 => NatoSW4 + HtoELLER
Natriumsulfat er et biprodukt fra produktionen af adskillige forbindelser. Det ekstraheres fra det flydende affald, der udledes under produktionen af viskose og cellofan. Også i produktionen af natriumdichromat, phenoler, borsyre og lithiumcarbamat.
Risici
Natriumsulfat betragtes som en forbindelse med lav toksicitet. Det kan dog skade den person, der bruger det forkert, noget..
For eksempel kan det forårsage øjenirritation, rødme og smerter ved kontakt. På huden kan det forårsage irritation og allergi hos nogle mennesker. Indtagelse kan forårsage irritation i fordøjelseskanalen med kvalme, opkastning og diarré. Og endelig producerer dets indånding irritation i luftvejene.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Natriumsulfat. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Natriumsulfat. PubChem-database. CID = 24436. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). Krystalstrukturen af NatoSW4III. Gendannet fra: rruff-2.geo.arizona.edu
- Glauberite-Thenardite (natriumsulfat). [PDF]. Gendannet fra: igme.es
Endnu ingen kommentarer