
Calciumsulfid (CaS) struktur, egenskaber, produktion, anvendelser

Det calciumsulfid Det er et uorganisk fast stof dannet af grundstoffet calcium (Ca) og grundstoffet svovl (S), den kemiske formel er CaS. Det er et gulhvidt fast stof, der er opløseligt i vand, findes i naturen i nogle vulkaner og i nogle meteoritter i form af et mineral kaldet oldhamit..
Når CaS opløses i vand, danner det forskellige forbindelser på grund af sulfidionen Sto- bliver ion SH- og OH-ioner dannes-. Den resulterende opløsning er alkalisk. Denne forbindelse bruges som en base for forbindelser, der er selvlysende eller som producerer synligt lys under visse betingelser. Disse materialer bruges også i lysende maling.

CaS er blevet betragtet som et muligt lægemiddel til behandling af hjerte- og blodkarproblemer såsom hypertension eller forhøjet blodtryk, som er en sygdom, der rammer en stor del af verdens befolkning.
Med calciumsulfid kan andre forbindelser såsom calciumnitrat og calciumcarbonat opnås. Det skal håndteres med forsigtighed og i kontakt med luftfugtigheden i atmosfæren kan det producere HtoS, som er meget giftig.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tæthed
- 3.5 Opløselighed
- 4 Kemiske egenskaber
- 4.1 Vandig opløsning
- 4.2 Forbindelser til stede, når de er opløst i vand
- 4.3 Reaktion med syrer
- 4.4 Andre reaktioner
- 5 Opnåelse
- 5.1 Tilstedeværelse i naturen
- 6 anvendelser
- 6.1 I lysende materialer
- 6.2 I medicin
- 6.3 Ved opnåelse af andre forbindelser
- 6.4 Andre anvendelser
- 7 risici
- 8 Referencer
Struktur
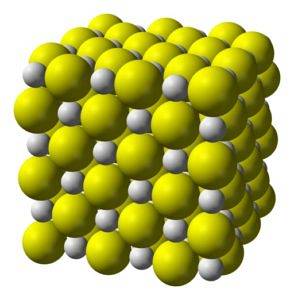
Calciumsulfid er en stærkt ionisk forbindelse dannet af en calciumion Cato+ og en sulfidion Sto-.
Krystalliserer til en kubisk struktur som sten salt.
Nomenklatur
- Calciumsulfid
Fysiske egenskaber
Fysisk tilstand
Gulhvide krystallinske faste, kubiske krystaller som dem af natriumchlorid.
Molekylær vægt
72,144 g / mol
Smeltepunkt
2528 ºC
Massefylde
2,59 g / cm3
Opløselighed
Opløselig i vand. Uopløselig i ethanol.
Kemiske egenskaber
Vandig opløsning
Da CaS opløses i vand, adskilles det i dets calcium Ca-ioner. to+ og svovl Sto-. Sidstnævnte i vand tager en proton og bliver hydrosulfidionen SH- frigivelse af en hydroxylion OH-.
Sto- + HtoO ⇔ SH- + Åh-
Derfor er calciumsulfid CaS-opløsninger alkaliske (har en basisk pH) og har ikke S-ioner.to- men SH-.
Først når en stor mængde alkali såsom natriumhydroxid NaOH tilsættes til opløsningen, skifter ligevægten mod dannelsen af sulfidioner Sto-.

SH- kan tage en anden proton H+ fra vand og danner hydrogensulfid, som er en meget giftig forbindelse.
SH- + HtoO ⇔ HtoS + OH-
Af denne grund dannes små mængder H i vand.toJa, og når det udsættes for fugt i miljøet afgiver CaS en ubehagelig lugt, der er typisk for hydrogensulfid.
Forbindelser til stede, når de opløses i vand
Resultatet af reaktionerne i vand angivet ovenfor er, at der dannes Ca (SH)to, Ca (OH)to og Ca (SH) (OH).
CaS + HtoO → Ca (SH) (OH)
Ca (SH) (OH) + HtoO → Ca (OH)to + HtoS
Reaktion med syrer
De samme reaktioner, der forekommer i vand, får CaS til at reagere med syrer, der danner HtoS.
CaS + 2 HCI → CaClto + HtoS
Andre reaktioner
Hvis en opløsning af calciumsulfid opvarmes med svovl, opnås polysulfidionerne S.4to- og S3to-.
Hvis CaS opvarmes i tør luft eller rent ilt, oxiderer forbindelsen til calciumsulfit CaSO3 og derefter til calciumsulfat CaSO4:
2 CaS + 3 Oto → 2 CaSO3
2 CaSO3 + ELLERto → 2 CaSO4
Med oxidationsmidler såsom kaliumchlorat KClO3, kaliumnitrat KNO3 eller blydioxid PbOto der opstår voldelige reaktioner.
Opnåelse
Calciumsulfid kan fremstilles ved calcinering (opvarmning til en meget høj temperatur) af elementerne calcium (Ca) og svovl (S) i en inert atmosfære, dvs. ingen oxygen eller vanddamp, for eksempel, er til stede..
Ca + S + varme → CaS
Det kan også opnås ved opvarmning af calciumsulfat CaSO4 med trækul:
Sag4 + 2 C → CaS + 2 COto
I sidstnævnte tilfælde opnås der imidlertid ikke en ren CaS, da den reagerer yderligere med CaSO4 danner CaO og SOto.
CaS genereres også ved forbrænding af kulaffald.
Tilstedeværelse i naturen
CaS er naturligt til stede i mineralet oldhamit. Dette er en komponent i nogle meteoritter og er vigtig for videnskabelig forskning udført på solsystemet..
Oldhamite menes at have dannet sig ved kondens i tågen, der stammer fra solsystemet. Det er også til stede i vulkaner.

Derudover produceres calciumsulfid naturligt ved reduktion af CaSO4 (gips) muligvis på grund af bakteriens virkning.
Ansøgninger
I lysende materialer
En af de mest udbredte anvendelser af calciumsulfid har været som en base for selvlysende forbindelser. Dette er stoffer, der udsender synligt lys under visse omstændigheder..
I de selvlysende forbindelser af CaS fungerer dette som en base, og aktivatorer tilsættes strukturen, såsom klorider af visse grundstoffer, såsom cerium (Ce3+) og europium (Euto+).
Materialet som følge af foreningen af CaS og aktivatoren bruges for eksempel i katodestrålerørskærme, der udgør de gamle skærme på computere eller computere eller gamle tv-apparater.

De bruges også i nuværende lysdioder eller LED-lamper. Lysdioder).

Disse materialer bruges også i lysende maling og lak..
I medicin
Calciumsulfid er blevet betragtet i medicinske videnskabelige undersøgelser som et lægemiddel til behandling af højt blodtryk (højt tryk i arterierne). Dette er en sygdom, der påvirker det kardiovaskulære system hos mange mennesker (hjerte og blodkar).
CaS betragtes som en “donor” af HtoS. Dette spiller en vigtig rolle i reguleringen af blodkarernes tone eller styrke, så indgivelse af CaS kan være et muligt middel til behandling af hypertension.

Ved opnåelse af andre forbindelser
Calciumsulfid gør det muligt at fremstille andre forbindelser såsom calciumnitrat Ca (NO3)to:
CaS + 2 HNO3 → Ca (NO3)to + HtoS
Det er også blevet brugt til at opnå calciumcarbonat CaCO3. For at gøre dette udsættes en vandig opløsning af CaS for kulsyre med COto:
CaS + HtoO + COto → HtoS + CaCO3
Andre apps
Calciumsulfid anvendes også som et smøremiddeladditiv og som et flotationsmiddel i mineralekstraktion..
Risici
Calciumsulfid kan forårsage hud-, øjen- og luftvejsirritation. Det skal håndteres med forsigtighed og med passende sikkerhedsudstyr.
Det er en meget giftig forbindelse for vandlevende organismer, så det er farligt for disse miljøer.
Referencer
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Lide, D.R. (redaktør). (2005). CRC Handbook of Chemistry and Physics. 85th CRC Tryk.
- Ropp, R.C. (2013). Gruppe 16 (O, S, Se, Te) alkaliske jordforbindelser. Calciumsulfid. I Encyclopedia of the Alkaline Earth Compounds. Gendannet fra sciencedirect.com.
- Li, Y.F. et al. (2009). Calciumsulfid (CaS), en donor af hydrogensulfid (H (2) S): et nyt antihypertensivt lægemiddel? Med Hypoteser, 2009 Sep; 73 (3): 445-7. Gendannet fra ncbi.nlm.nih.gov.
- Hus J.E. and House, K.A. (2016). Svovl, selen og Tellurium. Forekomst af svovl. In Descriptive Inorganic Chemistry (tredje udgave). Gendannet fra sciencedirect.com.
- OS. National Library of Medicine. (2019). Calciumsulfid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- De Beer, M. et al. (2014). Omdannelse af calciumsulfid til calciumcarbonat under genvindingen af elementært svovl fra gipsaffald. Affaldshåndtering, nov. 2014; 34 (11): 2373-81. Gendannet fra ncbi.nlm.nih.gov.



Endnu ingen kommentarer