
Tenecteplase hvad det er til, struktur, virkningsmekanisme, dosis
Det tenecteplase er en vævsplasminogenaktivator (tPA) syntetiseret af den farmaceutiske industri ved anvendelse af rekombinant DNA-teknikker anvendt på en cellelinie opnået fra ovarieceller fra kinesisk hamster.
Blodkoagulationsprocessen, som ender med dannelsen af en trombe og tilbagetrækningen af blodproppen, fortsætter med en fase kaldet fibrinolyse. Denne fase er karakteriseret ved opløsning af tromben gennem fragmenteringen af fibrinpolymeren i mindre og mere opløselige peptider og rekanalisering af beholderen eller beholderne, hvor koagulation fandt sted..
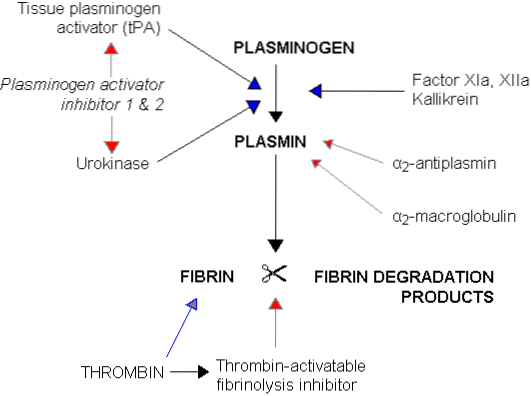
Denne fibrinolytiske proces kræver deltagelse af et blodprotein fra gruppen af plasmaglobuliner kaldet plasminogen eller profibrinolysin på ca. 81 kDa, syntetiseret i leveren og normalt til stede i cirkulerende blod. Dette plasminogen fanges under koagulation mellem fibrin-netværk, der udgør tromben..
Plasminogen i sig selv mangler enhver fibrinolytisk virkning, en handling, der kun vises, når det originale molekyle aktiveres og omdannes til plasmin eller fibrinolysin, som er en serinprotease, der meget ligner trypsin, som er det vigtigste proteolytiske fordøjelsesenzym i bugspytkirtelsekretion.
Plasmin har en høj affinitet for fibrin, som det nedbrydes til små opløselige peptider, der igen hæmmer thrombinens virkning og den efterfølgende produktion af mere fibrin. Det udøver også en proteolytisk virkning på fibrinogen, protrombin og koagulationsfaktorer V, VIII, IX, XI og XII, hvilket også reducerer blodets koagulationsevne.
Fra denne tabel kan det udledes, at plasmin påvirker blodkoagulationsprocesser på to måder, da det på den ene side producerer opløsning af tromben gennem dets fibrinolytiske virkning, og på den anden side interfererer det med koagulation gennem dets proteolytiske virkning. faktorer i koagulationsprocessen.
Artikelindeks
- 1 Hvad er tenecteplase til?
- 2 Molekylets struktur
- 3 Handlingsmekanisme
- 4 Præsentation
- 5 Dosis
- 6 Referencer
Hvad er tenecteplase til?
Plasminogenaktivering forekommer ved den individuelle eller kombinerede virkning af et sæt stoffer, der generisk kaldes plasminogenaktivatorer, og som ifølge deres oprindelse er grupperet i plasminogenaktivatorer: blod, urin, væv og fra mikroorganismer.
At være en vævsplasminogenaktivator, der omdanner det til plasmin, og plasmin er det fibrinolytiske middel par excellence, da tenecteplase bruges til terapeutisk fibrinolyse ved akut myokardieinfarkt, tromboemboliske slagtilfælde og lungetromboemboli..
Molekylets struktur
Tenecteplase er et glycoprotein, der har 527 aminosyrer i sin primære struktur, hvori der skelnes mellem to basiske domæner, den ene kaldes kringle-domænet og den anden svarer til proteasedomænet.
Kringledomænet er et område af proteinet, der foldes ind i store sløjfer, der er stabiliseret af disulfidbindinger. Denne type domæne er meget vigtig, fordi den tillader protein-protein-interaktioner, der opstår med blodkoagulationsfaktorer og modtager sit navn fra en skandinavisk kage, hvis form den ligner..
Proteasedomænet er det område af molekylet, der har den proteolytiske aktivitet, der giver enzymet dets aktiverende funktion selv..
Strukturen af molekylet er meget lig den for naturlig human tPA, men rekombinant DNA-teknologi tillod indførelsen af nogle modifikationer i dets komplementære DNA (cDNA), der giver proteinet kodet i det nogle terapeutiske fordele.
Disse modifikationer indbefatter substitution af threonin i position 103 med asparagin og asparagin 117 med glutamin, ændringer, der er lokaliseret i kringle-domænet; mens der i proteasedomænet blev opnået en tetra-alanin-samling i positionsområdet 296-299.
Handlingsmekanisme
Virkningsmekanismen for tenecteplase svarer til den naturlige tPA. Når tromben er dannet, binder plasminogen i sin inaktive form til fibrin uden at udøve nogen proteolytisk virkning på den..
TPA produceret af endotelceller binder til fibrin og derved erhverver dets plasminogenaktiverende egenskab i plasmin, et stof der udløser fibrinolyse.
Modifikationerne produceret i tPA-molekylet og inkorporeret i tenecteplase gør den aktiverende virkning af stoffet på plasminogen mere følsom over for tilstedeværelsen af fibrin. Fibrinspecificitet, der begrænser dens virkning til thrombussteder og reducerer systemisk plasminogenaktivering og den deraf følgende nedbrydning af plasma fibrinogen.
Præsentation
Doseringen eller styrken af stoffet udtrykkes i mg og i enheder (U) af tenecteplase. Enhederne repræsenterer en specifik referencestandard for lægemidlet og er ikke sammenlignelige med enhederne af andre trombolytiske midler. Én mg svarer til 200 enheder (U).
En forretningsform er Metalyse, der fås i to præsentationer, der hver har et hætteglas med produktet i form af et hvidt pulver og en fyldt injektionssprøjte med opløsningsmidlet, gennemsigtig og farveløs til rekonstitution.
I et af dem indeholder hætteglasset 8.000 enheder (40 mg) og sprøjten 8 ml solvens. I det andet indeholder hætteglasset 10.000 E (50 mg) og sprøjten 10 ml. I begge tilfælde, når opløsningen er rekonstitueret ved at tilføje sprøjtens indhold til det tilsvarende hætteglas, vil den indeholde 1000 enheder (5 mg) for hver ml og vises klar og farveløs eller lidt gul..
Dosis
Behandling med tenecteplase skal påbegyndes så hurtigt som muligt inden for 6 timer efter symptomdebut. På grund af den implicitte risiko for blødning eller blødning bør det ordineres af læger med erfaring i trombolytisk behandling og i institutioner med midler til at overvåge og modvirke denne type bivirkninger..

Doseringen af stoffet skal baseres på kropsvægt med en minimumsdosis på 6000 enheder svarende til 30 mg opløst i et volumen på 6 ml af den rekonstituerede opløsning, der skal administreres til patienter med en kropsvægt under 60 kg..
Den maksimale dosis er 10.000 E (50 mg / 10 ml opløsning) forbeholdt patienter med en legemsvægt på 90 kg og derover..
Doseringsplanen for patienter, hvis vægt er i intervallet 60 og under 90 kg, er som følger:
- ≥ 60 a < 70 = 7000 U (35 mg/7 ml)
- ≥ 70 a < 80 = 8000 U (40 mg/8 ml)
- ≥ 80 a < 90 = 9000 U (45 mg/9 ml)
Den krævede dosis skal administreres som en enkelt intravenøs bolus og over en periode på ca. 10 sekunder. Det kan administreres gennem et intravenøst kredsløb, der tidligere er forbundet, og hvorigennem en fysiologisk opløsning af natriumchlorid 0,9% (9 mg / ml) ledes.
Lægemidlet er inkompatibelt med glukoseopløsninger, og selvom adjuverende antitrombotisk behandling, der kan omfatte antiblodplader, og antikoagulantia bør administreres parallelt med de nuværende terapeutiske kriterier, bør der ikke tilsættes nogen anden medicin til den injicerbare opløsning af tenecteplase..
Referencer
- Balsera, E. C., Palomino, M. Á. P., Ordoñez, J. M., Caler, C. L., Paredes, T. G. og García, G. Q. (2011). Effektivitet og sikkerhed af alteplase versus tenecteplase ved fibrinolyse af akut koronarsyndrom med ST-elevation. Cardiocore, 46(4), 150-154.
- Bauer C og Walzog B: Blut: ein Flüssiges Organsystem, i: Fysiologi, 6. udgave; R Klinke et al. (Red.). Stuttgart, Georg Thieme Verlag, 2010.
- Fatovich, D. M., Dobb, G. J., & Clugston, R. A. (2004). En pilot randomiseret forsøg med trombolyse i hjertestop (TICA-forsøget). Genoplivning, 61(3), 309-313.
- Guyton AC, Hall JE: Hæmostase og blodkoagulation, i: Lærebog i medicinsk fysiologi , 13. udgave, AC Guyton, JE Hall (red.). Philadelphia, Elsevier Inc., 2016.
- Haley Jr, E. C., Lyden, P. D., Johnston, K. C., Hemmen, T. M., og TNK i Stroke Investigators. (2005). En pilotundersøgelse af sikkerhedsundersøgelse af dosis af tenecteplase ved akut iskæmisk slagtilfælde. Slag, 36(3), 607-612.
- Jelkman W: Blut, i: Physiologie des Menschen mit Pathophysiologie, 31. udgave, RF Schmidt et al (red.). Heidelberg, Springer Medizin Verlag, 2010.


Endnu ingen kommentarer