
Kaliumhypochlorit (KOCl) struktur, egenskaber
Det kaliumhypochlorit Det er kaliumsaltet af hypochlorsyre. Det er også et ternært salt af kalium, ilt og chlor og udgør en uorganisk forbindelse. Dens kemiske formel er KOCl, hvilket betyder, at kationen K findes i det ioniske faste stof.+ og anionen OCl- i et støkiometrisk forhold 1: 1.
Af deres homologe forbindelser (LiOCl, NaOCl, Ca (OCl)to) er måske den mindst anvendte og populært kendte inden for den kemiske og pragmatiske kultur. Alle disse salte har fællesnævneren for hypochloritanionen (OCl-), som giver dem deres vigtigste egenskaber som blegemiddel.
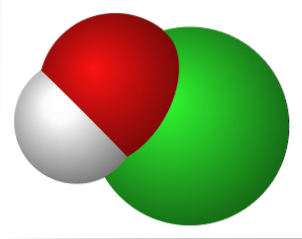
Historien om kaliumhypochlorit og dens fysisk-kemiske egenskaber svarer til natriumhypochloritsaltet. Det blev oprindeligt produceret i 1789 af Claude Louis Berthollet i Javel, Paris. Forfatterens reaktion, der førte til syntesen af forbindelsen, udtrykkes ved følgende kemiske ligning:
Clto + 2KOH => KCl + KClO + HtoELLER
Ifølge ligningen reagerer molekylært chlor med kaliumhydroxid (eller kaustisk kaliumchlorid), hvilket reducerer og oxiderer chloratomer. Dette kan verificeres ved at sammenligne oxidationsantalet af Cl i KCl (-1) med det for Cl i KClO (+1).
Artikelindeks
- 1 Kemisk struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Molær masse
- 3.2 Udseende
- 3.3 Tæthed
- 3.4 Smeltepunkt
- 3.5 Kogepunkt
- 3.6 Opløselighed i vand
- 3.7 Reaktivitet
- 4 anvendelser
- 5 Referencer
Kemisk struktur

Det øverste billede repræsenterer de elektrostatiske interaktioner mellem kationen K+ og anionen OCl- (med ilt, der bærer en negativ formel ladning).
Disse ioner har de samme støkiometriske proportioner (1: 1), og deres ikke-retningsbestemte kræfter danner et krystallinsk arrangement, hvor K+ er placeret tæt på O-atomet.
Selvom der ikke er nogen undersøgelser, der beskriver krystalsystemet af KOCl (kubisk, orthorhombisk, monoklinisk osv.), Er det nok at visualisere det som en stor K-sfære+ tiltrukket af den lineære geometriion af OCl-.
Man kan tro, at KOCl i modsætning til NaOCl danner krystaller med lavere gitterenergi, fordi K+ er større end Na+ sammenlignet med OCl-. Denne større forskel mellem deres ioniske radier gør de elektrostatiske kræfter, der findes mellem dem, mindre effektive..
Ydelsen i vandig opløsning for dette salt kan også forventes at være den samme som NaOCI. Omgivet af vand er K+ -mere voluminøs - den skal have en hydratiseringssfære, der er større end Na+. Ellers adskiller egenskaberne af dets opløsninger (farve, lugt og blegningskraft) ikke i væsentlig grad..
Nomenklatur
Hvorfor hedder kaliumhypochloritsaltet så? For at besvare dette skal man ty til nomenklaturen for ternære salte, der er underlagt IUPAC. Først og fremmest, fordi kalium kun har valens +1, er det unødvendigt at skrive det ned; derfor ignoreres det. Så skriv ikke kaliumhypochlorit (I).
Klorsyre har formlen HClO3. Når antallet af oxygener falder, vinder chloratomet flere elektroner; det vil sige, det har mindre positive oxidationstal. F.eks. Har Cl i denne syre et oxidationsnummer på +5.
Som i HClO har Cl et oxidationstal på +1, som derudover har to enheder mindre O-atomer (1 i stedet for 3 sammenlignet med HClO3), dets suffiks ændres til -oso. Da +1 er det mindste oxidationsnummer, som Cl-atomet kan nå, tilføjes præfikset -hypo ligeledes..
Så kaldes HClO hypochlorsyre. Imidlertid er KOCl dets kaliumsalt, og for Cl-oxidationstal mindre end +5 udskiftes suffikset -oso med suffikset -ito. Ellers ændres suffikset til -ate for oxidationstal, der er lig med eller større end +5. Så navnet forbliver kaliumhypochlorit.
Ejendomme
Molar masse
90,55 g / mol.
Udseende
Det er en let grålig væske.
Massefylde
1,16 g / cm3
Smeltepunkt
-2 ° C (28 ° F; 271 ° K). Dette lave smeltepunkt, på trods af dets ioniske karakter, viser den svage krystallinske gitterenergi af dets rene faste stof, et produkt af de monovalente ladninger af K+ og OCl-, og i modsætning til dens ioniske radier.
Kogepunkt
102 ° C (216 ° F, 375 ° K). Det er kun lidt højere end rent vand.
Vandopløselighed
25% w / v, hvilket er en rimelig værdi i betragtning af, at vandmolekyler er lette at solvere K-ioner+.
Vandige opløsninger af kaliumhypochlorit har blegekvaliteter, ligesom NaOCl. Det er irriterende og kan forårsage alvorlig skade i kontakt med hud, øjne og slimhinder. Ligeledes producerer dets inhalation bronchial irritation, åndedrætsbesvær og lungeødem..
Reaktivitet
-Kaliumhypochlorit er et kraftigt oxidationsmiddel, der ikke betragtes som et element, der forårsager brande eller eksplosioner. Det er dog i stand til at kombinere med forskellige kemiske grundstoffer for at producere brandfarlige og eksplosive forbindelser..
-I kontakt med urinstof kan det danne NCl3, en meget eksplosiv forbindelse. Når det opvarmes eller bringes i kontakt med syrer, producerer det meget giftig chloridrøg. Reagerer kraftigt med trækul i en potentielt eksplosiv reaktion.
-Det kombineres med acetylen til dannelse af den eksplosive chloracetylen. Ligeledes kan dets reaktion med organisk materiale, olie, kulbrinter og alkoholer forårsage eksplosioner. Dens reaktion med nitromethan, methanol og ethanol kan blive eksplosiv.
-Det nedbrydes frigivende ilt, en proces, der kan katalyseres af rust eller af metalbeholderen, der indeholder den..
-Kaliumhypochlorit skal opbevares koldt for at undgå dannelse af kaliumchlorat, hvis nedbrydning endda kan være eksplosiv..
Ansøgninger
-Anvendes som et desinfektionsmiddel for overflade og drikkevand.
-Nedbrydningen i jord af kaliumhypochlorit til kaliumchlorid har antydet, at den anvendes i afgrøder som kilde til kalium, et primært ernæringselement for planter..
-Nogle virksomheder har foreslået dets anvendelse som erstatning for NaOCl som blegemiddel og hævder de gunstige egenskaber ved K ion+ mod miljøpåvirkningen forårsaget af Na+.
Referencer
- Enviro Tech. Den natriumfri løsning. [PDF]. Hentet den 29. maj 2018 fra: envirotech.com
- PubChem. (2018). Kaliumhypochlorit. Hentet den 29. maj 2018 fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Kaliumhypochlorit. Hentet den 29. maj 2018 fra: en.wikipedia.org
- Kemikaliebog. (2017). Kaliumhypochlorit. Hentet den 29. maj 2018 fra: chemicalbook.com
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 873, 874.


Endnu ingen kommentarer