
Bufferløsningsegenskaber, forberedelse, eksempler

Det bufferløsninger eller buffere er dem, der kan nedsætte pH-ændringer på grund af H-ioner3ELLER+ og OH-. I mangel af disse skades nogle systemer (såsom fysiologiske), da deres komponenter er meget følsomme over for pludselige ændringer i pH.
Ligesom støddæmpere i biler reducerer påvirkningen forårsaget af deres bevægelse, gør buffere det samme, men med surhed eller basalitet af løsningen. Desuden etablerer buffere et specifikt pH-område, inden for hvilket de er effektive..

Ellers er H-ionerne3ELLER+ de syrner opløsningen (pH-værdien falder til værdier under 6), hvilket medfører en mulig ændring i reaktionsudbyttet. Det samme eksempel kan anvendes til basiske pH-værdier, dvs. større end 7.
Artikelindeks
- 1 Funktioner
- 1.1 Sammensætning
- 1.2 De neutraliserer både syrer og baser
- 1.3 Effektivitet
- 2 Forberedelse
- 3 eksempler
- 4 Referencer
Egenskaber
Sammensætning
De er i det væsentlige sammensat af en syre (HA) eller en svag base (B) og salte af deres konjugerede base eller syre. Derfor er der to typer: syrebuffere og alkaliske buffere..
Syrebuffere svarer til HA / A-parret-, hvorhen- er den konjugerede base af den svage syre HA og interagerer med ioner - såsom Na+- til dannelse af natriumsalte. På denne måde forbliver parret som HA / NaA, selvom de også kan være kalium- eller calciumsalte.
Afledt af den svage syre HA, puffer den sure pH-områder (mindre end 7) i henhold til følgende ligning:
HA + OH- => A- + HtoELLER
Da den er en svag syre, hydrolyseres dens konjugatbase imidlertid delvist for at regenerere en del af det forbrugte HA:
TIL- + HtoELLER <=> HA + OH-
På den anden side består alkaliske buffere af B / HB-parret+, hvor HB+ det er den konjugerede syre af den svage base. Generelt HB+ danner salte med chloridioner, hvilket efterlader parret som B / HBCl. Disse buffere buffer basiske pH-intervaller (større end 7):
B + H3ELLER+ => HB+ + HtoELLER
Og igen, HB+ kan delvist hydrolyseres for at regenerere en del af forbrugt B:
HB+ + HtoELLER <=> B + H3ELLER+
De neutraliserer både syrer og baser
Mens sure buffere bufferer sur pH og basiske buffere basisk pH, kan begge reagere med H-ioner.3ELLER+ og OH- gennem disse serier af kemiske ligninger:
TIL- + H3ELLER+ => HA + HtoELLER
HB+ + Åh- => B + HtoELLER
Således i tilfælde af HA / A-parret-, HA reagerer med OH-ioner-, mens A- -dens konjugerede base reagerer med H3ELLER+. Med hensyn til B / HB-parret+, B reagerer med H-ioner3ELLER+, mens HB+ -dets konjugerede syre med OH-.
Dette gør det muligt for begge buffere at neutralisere både sure og basiske arter. Resultatet af ovenstående versus f.eks. Den konstante tilsætning af mol OH-, er faldet i pH-variationen (ΔpH):
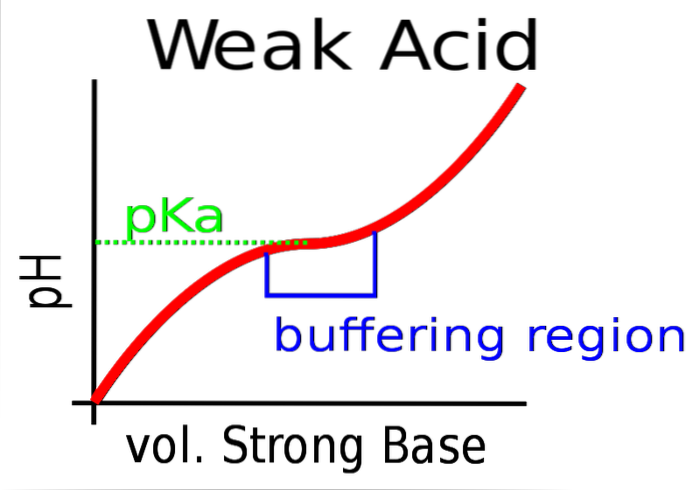
Det øverste billede viser buffringen af pH mod en stærk base (donor af OH-).
Oprindeligt er pH sur på grund af tilstedeværelsen af HA. Når den stærke base tilsættes, dannes de første mol A- og bufferen begynder at træde i kraft.
Der er dog et område af kurven, hvor skråningen er mindre stejl; det vil sige, hvor dæmpningen er mere effektiv (blålig boks).
Effektivitet
Der er flere måder at forstå begrebet dæmpningseffektivitet på. En af disse er at bestemme det andet derivat af kurven pH versus volumenet af base, løse for V for minimumsværdien, som er Veq / 2.
Veq er lydstyrken ved ækvivalenspunktet; dette er volumenet af base, der er nødvendigt for at neutralisere al syren.
En anden måde at forstå det på er gennem den berømte ligning fra Henderson-Hasselbalch:
pH = pKtil + log ([B] / [A])
Her betegner B basen, A syren og pKtil er den mindste logaritme af surhedskonstanten. Denne ligning gælder både for syrearten HA og for den konjugerede syre HB+.
Hvis [A] er meget stor i forhold til [B], tager loggen () en meget negativ værdi, der trækkes fra pKtil. Hvis [A] på den anden side er meget lille i forhold til [B], får værdien af log () en meget positiv værdi, som føjes til pKtil. Når [A] = [B] er loggen () imidlertid 0 og pH = pKtil.
Hvad betyder alt det ovenstående? At ΔpH vil være større i de ekstremer, der betragtes for ligningen, mens det vil være minimum med en pH lig med pKtil; og som pKtil er karakteristisk for hver syre, bestemmer denne værdi pK-områdettil± 1.
PH-værdierne inden for dette område er dem, hvor bufferen er mest effektiv..
Forberedelse
For at forberede en bufferløsning skal du huske følgende trin:
- Kend den krævede pH og derfor den, du vil holde så konstant som muligt under reaktionen eller processen.
- Når man kender pH-værdien, ser man efter alle svage syrer, dem hvis pKtil er tættere på denne værdi.
- Efter at have valgt HA-arten og beregnet koncentrationen af bufferen (afhængigt af hvor meget base eller syre der skal neutraliseres), vejes den nødvendige mængde af dens natriumsalt..
Eksempler
Eddikesyre har en pKtil af 4,75, CH3COOH; derfor en blanding af visse mængder af denne syre og natriumacetat, CH3COONa, danner en buffer, der effektivt buffrer i pH-området (3,75-5,75).
Andre eksempler på monoprotiske syrer er benzoesyrer (C6H5COOH) og formisk (HCOOH). For hver af disse er deres pK-værdiertil de er 4,18 og 3,68; derfor er deres højeste buffer-pH-intervaller (3.18-5.18) og (2.68-4.68).
På den anden side er polyprotiske syrer såsom fosforsyre (H3PO4) og kulsyre (HtoCO3) har så mange pK-værdiertil som protoner kan frigøre. Således er H3PO4 har tre pKtil (2,12, 7,21 og 12,67) og HtoCO3 har to (6.352 og 10.329).
Hvis du vil opretholde en pH-værdi på 3 i en opløsning, kan du vælge mellem HCOONa / HCOOH (pKtil= 3,68) og NaHtoPO4/ H3PO4 (pKtil= 2,12).
Den første buffer, myresyre, er tættere på pH 3 end phosphorsyrebufferen; derfor puffer HCOONa / HCOOH bedre ved pH 3 end NaHtoPO4/ H3PO4.
Referencer
- Day, R., & Underwood, A. Kvantitativ analytisk kemi (femte udgave). PEARSON Prentice Hall, s 188-194.
- Avsar Aras. (20. april 2013). Mini stød. Hentet den 9. maj 2018 fra: commons.wikimedia.org
- Wikipedia. (2018). Bufferopløsning. Hentet den 9. maj 2018 fra: en.wikipedia.org
- Assoc. Prof. Lubomir Makedonski, ph.d. [Dok.]. Bufferløsninger. Medical University of Varna.
- Chem Collective. Buffer tutorials. Hentet den 9. maj 2018 fra: chemcollective.org
- spørgeIITere. (2018). Bufferløsning. Hentet den 9. maj 2018 fra: askiitians.com
- Quimicas.net (2018). Eksempler på buffer-, buffer- eller bufferløsninger. Hentet den 9. maj 2018 fra: quimicas.net

Endnu ingen kommentarer