
Molekylær kinetisk teorihistorie, postulater og eksempler

Det molekylær kinetisk teori Det er en, der søger at forklare de eksperimentelle observationer af gasser fra et mikroskopisk perspektiv. Det vil sige, det forsøger at forbinde naturen og opførslen af de gasformige partikler med de fysiske egenskaber ved gassen som en væske; forklare det makroskopiske fra det mikroskopiske.
Gasser har altid været af interesse for forskere på grund af deres egenskaber. De optager hele volumenet af beholderen, hvori de findes, og er i stand til at blive komprimeret fuldstændigt, uden at deres indhold modsætter sig mindst modstand og hvis temperaturen stiger, begynder beholderen at ekspandere og kan endda knække.
Mange af disse egenskaber og adfærd er opsummeret i de ideelle gaslove. De betragter dog gassen som en helhed og ikke som en samling af millioner af partikler spredt i rummet; Desuden giver den ikke, baseret på tryk, volumen og temperaturdata, yderligere oplysninger om, hvordan disse partikler bevæger sig.
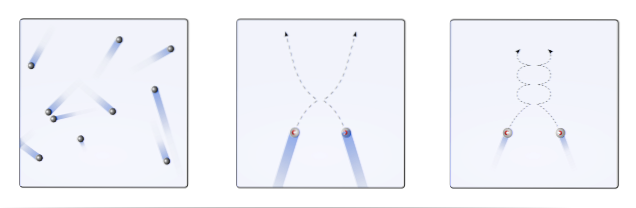
Det er således så, at den molekylære kinetiske teori (TCM) foreslår at visualisere dem som mobile kugler (øverste billede). Disse kugler kolliderer med hinanden og væggene vilkårligt og opretholder en lineær bane. Men når temperaturen falder, og trykket stiger, bliver kuglernes bue buet..
En gas skal ifølge TCM opføre sig som kuglerne i billedets første ramme. Men ved at køle ned og øge presset på dem er deres adfærd langt fra ideel. De er derefter ægte gasser, der er tæt på at gennemgå kondensering og overgår således til væskefasen.
Under disse forhold bliver samspillet mellem kuglerne vigtigere, til det punkt, at deres hastigheder kortvarigt sænkes. Jo tættere de er på kondensering, jo mere kurvede bliver deres baner (indsat til højre), og jo mindre energiske bliver deres kollisioner..
Artikelindeks
- 1 Historie
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell og Ludwig Boltzmann
- 2 Postulater af molekylær kinetisk teori
- 2.1 Volumenet af de gasformige partikler er ubetydeligt
- 2.2 Tiltrækningskræfterne mellem partiklerne er nul
- 2.3 Gasformige partikler er altid i bevægelse
- 2.4 Kollisioner mellem partikler og beholdervægge er elastiske
- 2.5 Kinetisk energi forbliver ikke konstant
- 2.6 Den gennemsnitlige kinetiske energi er lig med en given temperatur for alle gasser
- 3 eksempler
- 3.1 Boyles lov
- 3.2 Charles's Law
- 3.3 Daltons lov
- 4 Referencer
Historie
Daniel Bernoulli
Tanken om disse sfærer, bedre kaldet atomer, var allerede blevet overvejet af den romerske filosof Lucretius; ikke til gasser, men til faste, statiske genstande. På den anden side anvendte Daniel Bernoulli i 1738 atomvisionen på gasser og væsker ved at forestille sig dem som uordnede sfærer, der bevæger sig i alle retninger..
Hans arbejde overtrådte dog fysikens love på det tidspunkt; et legeme kunne ikke bevæge sig evigt, så det var umuligt at tro, at et sæt atomer og molekyler ville kollidere med hinanden uden at miste deres energi; eksistensen af elastiske kollisioner var ikke mulig.
Rudolf clausius
Et århundrede senere forstærkede andre forfattere TCM med en model, hvor de gasformige partikler kun bevægede sig i en retning. Rudolf Clausius samlede imidlertid sine resultater og sammensatte en mere komplet TCM-model, hvormed han forsøgte at forklare de ideelle gaslove, der blev demonstreret af Boyle, Charles, Dalton og Avogadro..
James Clerk Maxwell og Ludwig Boltzmann
I 1859 erklærede James Clerk Maxwell, at gasformige partikler udviser en række hastigheder ved en given temperatur, og at et sæt af dem kan overvejes ved hjælp af en gennemsnitlig molekylær hastighed..
I 1871 forbandt Ludwig Boltzmann eksisterende ideer med entropi, og hvordan gastermodynamisk altid har en tendens til at optage så meget plads som muligt homogent og spontant.
Postulater af molekylær kinetisk teori
For at betragte gassen fra dens partikler er en model nødvendig, hvor visse postulater eller antagelser er opfyldt; postulerer, der logisk skal være i stand til at forudsige og forklare (så nøjagtigt som muligt) makroskopiske og eksperimentelle observationer. Når det er sagt, er TCM-postulaterne nævnt og beskrevet.
Volumenet af de gasformige partikler er ubetydeligt
I en beholder fyldt med luftformige partikler spredes disse og bevæger sig væk fra hinanden i alle hjørner. Hvis de et øjeblik kunne alle samles på et bestemt sted i beholderen uden fortætning, ville det bemærkes, at de kun optager en ubetydelig del af beholderens volumen..
Det betyder, at beholderen, selvom den indeholder millioner af luftformige partikler, faktisk er mere tom end fuld (volumen-hulrumsforhold meget mindre end 1); derfor, hvis dets barrierer tillader det, kan det og gassen inde i det komprimeres brat; da i slutningen af dagen er partiklerne meget små, ligesom deres volumen er.
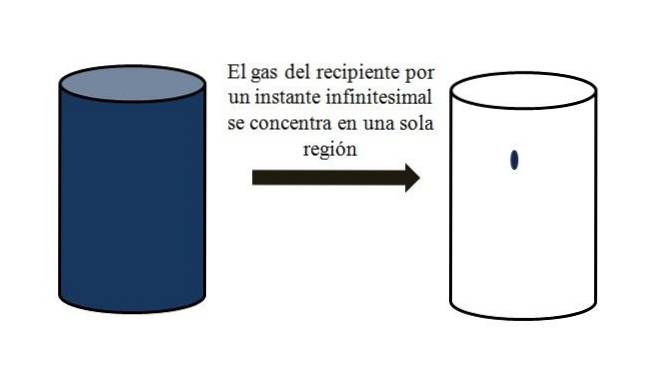
Det øverste billede illustrerer nøjagtigt ovenstående ved hjælp af en blåfarvet gas.
De attraktive kræfter mellem partiklerne er nul
De gasformige partikler inde i beholderen kolliderer med hinanden uden tilstrækkelig tid til, at deres interaktioner får styrke; endnu mindre, når det, der primært omgiver dem, er molekylært vakuum. En umiddelbar konsekvens af dette er, at deres lineære stier giver dem mulighed for fuldstændigt at omfatte beholderens volumen..
Hvis dette ikke var tilfældet, ville en beholder med en "bizar" og "labyrintisk" form have fugtige områder som et resultat af gaskondens; i stedet bevæger partiklerne sig rundt i beholderen med fuld frihed, uden at kraften i deres interaktioner stopper dem.
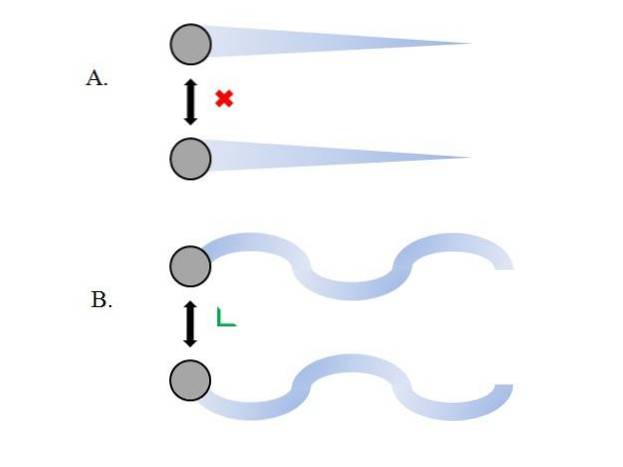
De lineære baner i det øverste billede (A.) demonstrerer dette postulat; mens banerne er buede (B.), viser det, at der er interaktioner, der ikke kan ignoreres mellem partiklerne.
Gasformige partikler er altid i bevægelse
Fra de to første postulater konvergerer også det faktum, at gaspartiklerne aldrig bevæger sig. Når de er sløret i beholderen, kolliderer de med hinanden og med dens vægge med en kraft og hastighed, der er direkte proportional med den absolutte temperatur; denne kraft er tryk.
Hvis de gasformige partikler stoppede med at bevæge sig et øjeblik, ville "røgtunger" blive vidne inde i beholderen, der kom ud fra ingenting, med tilstrækkelig tid til at arrangere sig selv i et vakuum og give tilfældige former..
Kollisioner mellem partiklerne og beholdervæggene er elastiske
Hvis kun elastiske kollisioner mellem de gasformige partikler og væggene i beholderen dominerer inde i beholderen, vil kondensering af gassen aldrig forekomme (så længe de fysiske forhold ikke ændres); eller hvad er det samme som at sige, at de aldrig hviler og altid kolliderer.
Dette skyldes, at der ved elastiske kollisioner ikke er noget nettotab af kinetisk energi; en partikel kolliderer med væggen og hopper i samme hastighed. Hvis en partikel, når den kolliderer, sænkes, accelererer den anden uden at producere varme eller lyd, der spreder den kinetiske energi hos en af dem.
Kinetisk energi forbliver ikke konstant
Partiklernes bevægelse er tilfældig og kaotisk, så de ikke alle har samme hastighed; ligesom det sker for eksempel på en motorvej eller i en menneskemængde. Nogle er mere energiske og rejser hurtigere, mens andre er langsomme og venter på en kollision for at fremskynde dem.
For at beskrive dens hastighed er det derefter nødvendigt at beregne et gennemsnit; og med dette opnås den gennemsnitlige kinetiske energi for de gasformige partikler eller molekyler igen. Da den kinetiske energi for alle partiklerne konstant ændrer sig, giver gennemsnittet bedre kontrol af dataene og kan arbejdes med større pålidelighed..
Den gennemsnitlige kinetiske energi er lig med en given temperatur for alle gasser
Gennemsnitlig molekylær kinetisk energi (ECsmp) i en beholder ændres med temperaturen. Jo højere temperaturen er, jo højere bliver energien. Fordi det er et gennemsnit, kan der være partikler eller gasser, der har højere eller lavere energi end denne værdi; nogle hurtigere og nogle langsommere.
Matematisk kan det vises, at ECsmp det afhænger udelukkende af temperaturen. Dette betyder, at uanset hvad gassen er, dens masse eller molekylære struktur, dens ECsmp den vil være den samme ved en temperatur T og vil kun variere, hvis den stiger eller falder. Af alle postulaterne er dette måske den mest relevante..
Og hvad med den gennemsnitlige molekylære hastighed? I modsætning til EFsmp, molekylær masse påvirker hastigheden. Jo tungere den gasformige partikel eller molekyle, det er naturligt at forvente, at den bevæger sig langsommere..
Eksempler
Her er nogle korte eksempler på, hvordan TCM har formået at forklare de ideelle gaslove. Selvom det ikke behandles, kan andre fænomener, såsom gasdiffusion og effusion, også forklares med TCM.
Boyles lov
Hvis beholderens volumen komprimeres ved konstant temperatur, aftager den afstand, som de gasformige partikler skal bevæge sig for at kollidere med væggene; hvilket er lig med en stigning i hyppigheden af sådanne kollisioner, hvilket resulterer i større tryk. Da temperaturen forbliver konstant, er ECsmp det er også konstant.
Charles Law
Hvis du øger T, ECsmp vil stige. De gasformige partikler bevæger sig hurtigere og kolliderer et større antal gange med beholderens vægge; så stiger trykket.
Hvis væggene er fleksible og i stand til at ekspandere, bliver deres areal større, og trykket falder, indtil det bliver konstant; og som et resultat øges lydstyrken også.
Daltons lov
Hvis der blev tilsat flere liter forskellige gasser til en rummelig beholder, der kommer fra mindre beholdere, ville dens samlede indre tryk være lig summen af det delvise tryk, der udøves af hver gastype separat..
Hvorfor? Fordi alle gasser begynder at kollidere med hinanden og spredes homogent; interaktionerne mellem dem er nul, og vakuumet dominerer i beholderen (TCM-postulater), så det er som om hver gas var alene og udøvede sit tryk individuelt uden interferens fra de andre gasser.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Learning, P 426-431.
- Fernandez Pablo. (2019). Molekylær kinetisk teori. Vix. Gendannet fra: vix.com
- Jones, Andrew Zimmerman. (7. februar 2019). Kinetisk molekylær teori om gasser. Gendannet fra: thoughtco.com
- Hall Nancy. (5. maj 2015). Kinetisk teori om gasser. Glenn Research Center. Gendannet fra: grc.nasa.gov
- Blaber M. & Lower S. (9. oktober 2018). Grundlæggende om kinetisk molekylær teori. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Den kinetiske molekylære teori. Gendannet fra: chemed.chem.purdue.edu
- Wikipedia. (2019). Kinetisk teori om gasser. Gendannet fra: en.wikipedia.org
- Toppr. (s.f.). Kinetisk molekylær teori om gasser. Gendannet fra: toppr.com

Endnu ingen kommentarer