
Sporfarvning begrundelse, teknikker og anvendelser

Det sporfarvning Det er den metode, der bruges til at farve resistensstrukturer, der danner nogle bakterieslægter, når de er under ugunstige forhold disse strukturer svarer til en form for overlevelse.
Der er mange slægter, der danner sporer; de vigtigste er dog Bacillus og Clostridium. Disse slægter betragtes som mere relevante, fordi de har arter, der er patogene for mennesker..
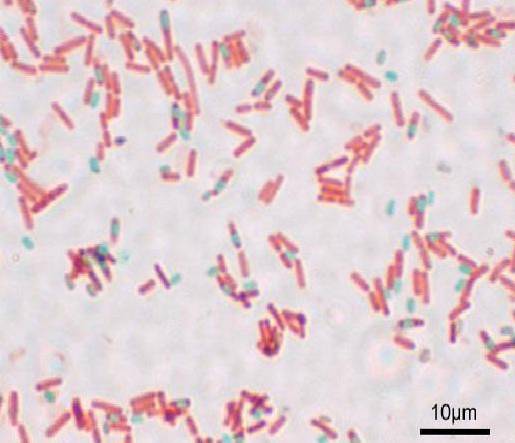
Hver bacillus kan give anledning til en spore. På tidspunktet for farvning af præparatet kan sporen findes i bacillus (endospore) eller uden for den (exospore). Med konventionelle farvningsteknikker for bakterier - som Gram-pletten - forbliver sporerne farveløse.
I øjeblikket er der flere farvningsmetoder, der er i stand til at trænge ind i sporens tykke struktur for at farve det. Disse metoder er meget varierede; Disse inkluderer Dorner-teknikken, Möeller-pletten og Shaeffer-Fulton-metoden, også kendt som Wirtz-Conklin..
Af alle de nævnte teknikker er Shaeffer-Fulton-metoden den mest anvendte i rutinelaboratorier. Det er opkaldt efter to mikrobiologer, der skabte farven i 1930: Alicia Shaeffer og MacDonald Fulton. Imidlertid kaldes teknikken undertiden Wirtz-Conklin til ære for to bakteriologer fra 1900'erne..
Artikelindeks
- 1 begrundelse
- 2 Sporfarvningsteknikker
- 2.1 Dorner-teknik
- 2.2 Modificeret Dorner-teknik
- 2.3 Shaeffer-Fulton eller Wirtz-Conklin teknik
- 2.4 Möeller-teknik
- 2.5 Modificeret Möeller-teknik uden varme
- 3 anvendelser
- 3.1 Eksempler
- 4 Referencer
Basis
Sporerne pletter ikke med konventionelle pletter, fordi de har en meget tyk væg. Sporernes komplekse sammensætning forhindrer indtrængen af de fleste farvestoffer.
Hvis sporen undersøges udefra og ind, observeres følgende lag: først er exosporium, som er det tyndeste og ydre lag dannet af glykoproteiner.
Dernæst kommer neglebåndet, som giver modstandsdygtighed over for høje temperaturer efterfulgt af cortex sammensat af peptidoglycan. Senere er væggen på basen, der beskytter protoplasten.
Sporen er en dehydreret struktur, der indeholder 15% calcium og dipicolinsyre. Af denne grund er de fleste sporefarvningsteknikker afhængige af påføring af varme, så farvestoffet kan trænge igennem den tykke struktur..
Når sporen er plettet, kan den ikke fjerne farvestoffet. I Shaeffer-Fulton-teknikken kommer malakitgrønt ind i vegetative celler, og når varme påføres, trænger det også ind i endosporen og exosporer..
Ved vask med vand fjernes farvestoffet fra den vegetative celle. Dette sker, fordi malakitgrønt farvestof er lidt grundlæggende, så det binder svagt til den vegetative celle..
I stedet kan den ikke komme ud af sporen, og bacillusen bliver i sidste ende modfarvet med safranin. Dette fundament er gyldigt for resten af teknikkerne, hvor der sker noget lignende.
Sporfarvningsteknikker
For at udføre sporefarvning skal du have en ren kultur af den mistænkelige stamme, du vil studere..
Kulturen udsættes for ekstreme temperaturer i 24 timer for at stimulere mikroorganismen til at sporulere. Til dette kan kulturen placeres i en ovn ved 44 ° C eller i køleskab (8 ° C) i 24 eller 48 timer..
Hvis de efterlades for længe ved de nævnte temperaturer, vil kun exosporer blive observeret, da alle endosporer allerede har forladt bacillus.
Ved slutningen af tiden skal et par dråber steril fysiologisk opløsning placeres på et rent dias. Derefter tages en lille del af kulturen, og der laves en fin spredning.
Derefter lades den tørre, sættes i varmen og farves med en af nedenstående teknikker:
Dorner-teknik
1- Forbered en koncentreret suspension af den sporulerede mikroorganisme i destilleret vand i et reagensglas, og tilsæt et lige så stort volumen filtreret Kinyoun carbol fuchsin.
2- Anbring røret i et kogende vandbad i 5 til 10 minutter.
3- Bland en dråbe af den foregående suspension med et dråbe af en 10% vandig opløsning af nigrosin på et rent dias, kogt og filtreret..
4- Spred og tør hurtigt med mild varme.
5- Undersøg med et 100X mål (nedsænkning).
Sporer pletter røde og bakterieceller ser næsten farveløse ud mod en mørkegrå baggrund.
Modificeret Dorner-teknik
1- En suspension af den sporulerede mikroorganisme spredes på et dias og fikseres i varmen.
2- Prøven er dækket med en filterpapirstrimmel, hvortil der tilsættes carbolisk fuchsin. Farvestoffet opvarmes i 5 til 7 minutter med Bunsen-brænderens flamme, indtil udviklingen af damp genereres. Derefter fjernes papiret.
3- Præparatet vaskes med vand og tørres derefter med absorberende papir.
4- Dæk udstrygningen med en tynd film af 10% nigrosin ved hjælp af et andet objektglas til at sprede nigrosinet eller en nål.
Farven, som sporer og bakterier tager, er den samme som beskrevet i den kendte teknik.
Shaeffer-Fulton eller Wirtz-Conklin teknik
1- Lav et fint udstrygning med en suspension af den sporulerede mikroorganisme på et dias og fastgør det til varme.
2- Dæk objektglasset med 5% malakitgrøn vandig opløsning (et filterpapir kan placeres på objektglasset).
3- Varm over flammen på Bunsen-brænderen for at forårsage frigivelse af dampe og fjern flammen. Gentag operationen i 6 til 10 minutter. Hvis den malakitgrønne opløsning fordamper for meget under proceduren, mere.
4- Fjern filterpapiret (hvis det er installeret) og vask med vand.
5- Dæk objektglasset med 0,5% vandigt safranin i 30 sekunder (nogle varianter af teknikken bruger 0,1% vandigt safranin og lad det stå i 3 minutter).
Med denne teknik fremstår sporerne grønne og bacillerne røde..
Det har den ulempe, at endosporer i unge kulturer ikke pletter godt, da de ser meget klare eller farveløse ud. For at undgå dette anbefales det at anvende kulturer med 48 timers inkubation..
Möeller teknik
1- Dæk udstrygningen med chloroform i 2 minutter.
2- Bortskaf chloroformen.
3- Dæk med 5% chromsyre i 5 minutter.
4- Vask med destilleret vand
5- Arket er dækket af carbol fuchsin-fenicada og udsat for flammen fra Bunsen-brænderen indtil emissionen af dampe; derefter fjernes den fra flammen et øjeblik. Operationen gentages, indtil 10 minutter er afsluttet.
6- Vask med vand.
7- Brug forsuret ethanol (saltsprit) til at misfarve. Lad være i 20 eller 30 sekunder.
8- Vask med destilleret vand.
9- Kontraster ved at dække arket med methylenblåt i 5 minutter.
10- Vask med destilleret vand.
11- Lad det tørre, og tag prøven med til mikroskopet.
Sporerne ser røde ud og bacillerne blå. Det er vigtigt ikke at indånde dampene, da de er giftige og på lang sigt kan være kræftfremkaldende..
Varmeløs modificeret Möeller-teknik
I 2007 skabte Hayama og hans samarbejdspartnere en modifikation af Möeller-teknikken. De eliminerede trinnet med opvarmning af farvestoffet og udskiftede det med tilsætning af 2 dråber af det overfladeaktive middel Tergitol 7 for hver 10 ml carbol-fuchsin-carbol-opløsning. De samme resultater blev opnået.
Ansøgninger
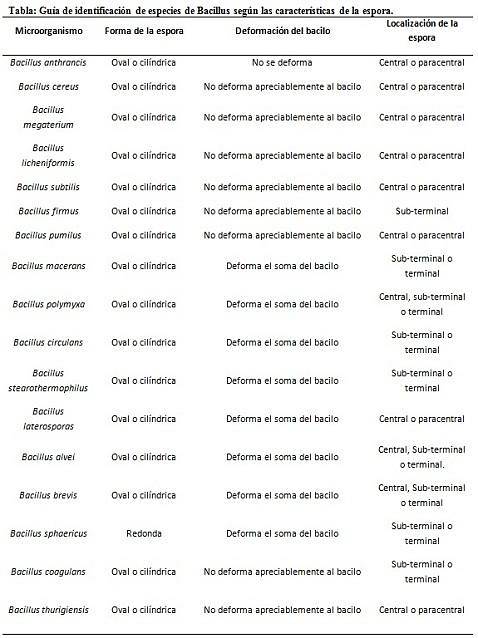
Farvning af sporer giver meget værdifuld og nyttig information til identifikation af patogenet, da dets tilstedeværelse, dets form, placering inden i bacillus og evnen til at deformere den vegetative celle eller ej, er data, der kan guide arten. Involveret i en bestemt genre.
I denne sammenhæng er det værd at sige, at sporene kan være runde eller ovale, de kan være placeret i midten eller også i en paracentral, subminale eller terminal position..
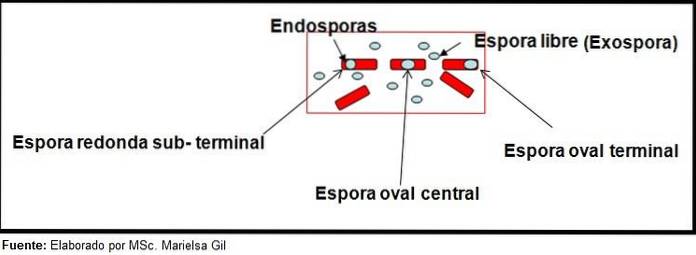
Eksempler
- Clostridium difficile danner en oval spore i terminal position, der deformerer bacillus.
- Sporen af Clostridium tertium det er ovalt, deformerer ikke basillen og er placeret på terminal niveau.
- Endosporen af Clostridium tetani er terminal og deformerer bacillus, hvilket giver udseendet af en trommestok.
- Sporer af Clostridium botulinum, C. histolyticum, C. novy Y C. septicum de er runde eller ovale underterminaler og deformerer basillen.
- Endosporen af Clostridium sordelli er placeret i den centrale position med en let deformation.
Referencer
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Forslag om en forenklet teknik til farvning af bakteriesporer uden at anvende varmesuccesfuld modifikation af Moellers metode. Eur J Med Res.2007; 16 12 (8): 356-9.
- Wikipedia-bidragydere. Moeller plet. Wikipedia, The Free Encyclopedia. 3. november 2018, 03:28 UTC. Tilgængelig på: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Laboratorievejledning til mikrobiologiske teknikker. Institut for Grundvidenskab Akademi for Mikrobiologi. National Polytechnic Institute.
- "Endospore." Wikipedia, The Free Encyclopedia. 25 feb 2018, 10:20 UTC. 10. jan 2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J og samarbejdspartnere. (2006). Arbejdspersonale i det autonome samfund Extremadura. Specifik dagsorden bind IV. MAD redaktionelt. Sevilla-Spanien, s. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006). Laboratoriespecialist, galicisk sundhedstjeneste (SERGAS). Specifikt emne dagsorden bind 2. Leder MAD. Sevilla-Spanien, s. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. udgave). Argentina, redaktionelt Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiologisk diagnose. 12. udgave Argentina. Redaktionel Panamericana S.A



Endnu ingen kommentarer