
Bromothymolblå struktur, egenskaber, forberedelse, anvendelser
Det bromothymolblåt Det er et farvestof, der er følsomt over for dets miljøs pH og er blevet brugt som en indikator i mange laboratoriereaktioner. En indikator er et organisk farvestof, hvis farve afhænger af koncentrationen af H-ionen.3ELLER+ eller mediumets pH. Af den farve, den viser, kan indikatoren angive surhedsgraden eller basiteten af opløsningen.
Bromothymolblåt har en aktiv indikationsskala mellem pH 6,0 og 7,6. Ved en pH på mediet lavere end 6,5 viser den en gul farve. Når pH i mediet varierer mellem 6,5 og 7,6, får det en grøn farve. Ved pH større end 7,6 er farven blå.

Denne egenskab gør denne indikator meget nyttig, da den kan bruges i en pH-skala tæt på neutralitet; netop hvor fysiologiske processer forekommer.
Ioniseringen af bromothymolblåt i vandig opløsning kan skitseres som følger:
HIn (gul farve) + HtoELLER <=> I- (blå farve) + H3ELLER+
Når indikatoren er protoneret (HIN) får den en gul farve; derimod hvis den deprotonerede indikator (I-) bliver blå.
Artikelindeks
- 1 Kemisk struktur
- 1.1 pH-ændringer
- 2 egenskaber
- 2.1 Kemisk navn
- 2.2 Molekylær formel
- 2.3 Molekylvægt
- 2.4 Fysisk udseende
- 2.5 Kemisk egenskab
- 2.6 Ionisk dissociationskonstant (Ka)
- 2.7 Aktivt indikationsområde
- 2.8 Tæthed
- 2.9 Smeltepunkt
- 2.10 Kogepunkt
- 2.11 Opløselighed
- 2.12 Stabilitet
- 2.13 Lysabsorption
- 3 Anvendelser og applikationer
- 3.1 I metaboliske undersøgelser
- 3.2 I fødselslæge
- 3.3 Andre anvendelser
- 4 Forberedelse
- 5 Referencer
Kemisk struktur
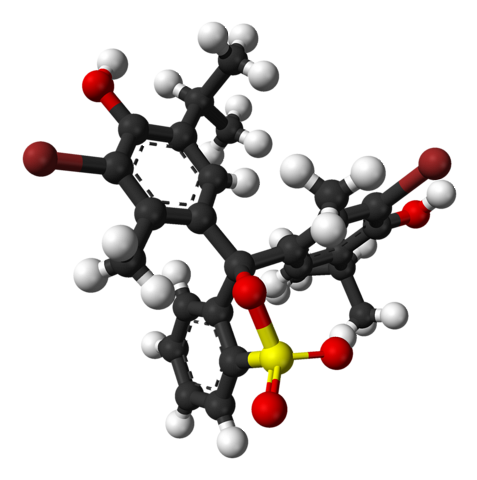
Det øverste billede repræsenterer strukturen af bromothymolblåt med en stang- og kuglemodel ved en pH lavere end 7,1. De brune søjler svarer til bromatomer, to i alt.
Hver af de tre aromatiske ringe sammensætter sammen med methylgrupperne CH3, og tertbutyl, thymolgruppen; og efter at have bundet en Br, derfra opstår grunden til, at den kaldes 'bromothymol'.
Nederst er sulfonatgruppen, R-SO3-, med røde kugler og en gul. Denne gruppe kan forbindes gennem et O-atom til det centrale kulstof, der forbinder de tre aromatiske ringe.
PH ændres
Selvom denne molekylære struktur ikke ændrer sig radikalt med sur eller basisk pH, ændres dens elektroniske tilstande, hvilket reflekteres af ændringer i opløsningenes farve.
Under pH 7 er indikatoren gul i farven og vedtager billedets struktur; men hvis pH bliver basisk, kan -OH-grupperne deprotoneres, og der kan dannes en C = O-dobbeltbinding.
Som et resultat ændres det konjugerede system af molekylet (det af alle dets resonante dobbeltbindinger) nok til, at elektronerne ikke længere absorberer de samme fotoner, og opløsningen bliver fra gul til blålig..
Hvis pH-værdien derimod er et godt stykke under 7, skifter indikatorens farve fra gul til rød. Her skyldes ændringen i det konjugerede system protonationen af -OH-grupperne til -OHto+. -
I både sure og basiske miljøer mister molekylet stabilitet og absorberer fotoner med lavere energi for at tillade de elektroniske overgange, der er ansvarlige for de farver, som tilskuerne opfatter..
Og hvad med hovedbilledets grønne farve? Når pH nærmer sig 7,1, mister en lille del af molekyler protoner og afgiver en blå farve, der, når den blandes med gul, giver farven grøn..
Ejendomme
Kemisk navn
Bromothymolblåt eller 3,3'-dibromthymolsulfonaphthalein.
Molekylær formel
C27H28BrtoELLER5S.
Molekylær vægt
624,384 g / mol.
Fysisk fremtoning
Fast pulver med en farve, der spænder fra lyserød til lilla.
Kemisk egenskab
Det fungerer som en svag syre i opløsning. Når det protoneres i et surt medium, får det en gul farve, ved neutral pH er den grøn, og når den deprotoneres i en alkalisk pH, er den blå.
Ionisk dissociationskonstant (Ka)
7,9 x 10-8.
Aktivt indikationsområde
pH 6,0 til 7,6. Dette skyldes tilstedeværelsen af bromatomer, der virker til at ekstrahere elektroner, og to moderate elektrondonorgrupper (alkylsubstituenter).
Massefylde
1,25 g / cm3.
Smeltepunkt
202 ºC (396 º F).
Kogepunkt
184,9 ºC.
Opløselighed
Det er dårligt opløseligt i vand og olie. Ligeledes er den dårligt opløselig i ikke-polære opløsningsmidler, såsom benzen, toluen og xylen, og praktisk talt uopløselig i petroleumsether. Det er opløseligt i vandige alkaliske opløsninger og i alkohol.
Stabilitet
Den er stabil ved stuetemperatur og er uforenelig med stærke oxidationsmidler.
Lysabsorption
Den protonerede form har sin maksimale absorption ved en bølgelængde (λ) på 427 nm og transmitterer således gult lys i syreopløsninger, og den deprotonerede form har en maksimal absorption ved en bølgelængde (λ) på 602 nm, der transmitterer et blåt lys. Ved alkalisk pH.
Anvendelser og applikationer
I metaboliske undersøgelser
Bromothymolblåt bruges i mange processer, hvor kuldioxid (COto) med den deraf følgende dannelse af kulsyre (HtoCO3), som forsyrer mediet; fremgår af en ændring i farven af bromothymolblåt.
Hvis en person udøver fysisk træning og er forbundet med et rør, der igen er forbundet til en beholder med en bromothymolblå opløsning, vil følgende fænomen blive observeret: som en konsekvens af øget fysisk aktivitet og stofskifte vil der være en stigning i produktionen af COto.
COto vil reagere med vand og producere kulsyre, HtoCO3, som efterfølgende adskiller frigivelse af H-ionen+ og forsuring af mediet. Som en konsekvens får bromothymolblåt en gul farve og fremhæver mediets surhed..
I fødselslæge
Bromothymolblåt bruges i fødselslæge for at vise tidlig membranbrud. Fostervand har normalt en pH-værdi på over 7,7, så bromothymolblåt bliver blåt, når det kommer i kontakt med væsken, der lækker fra amnionen..
Vaginal pH er normalt sur, så bromothymolblåt har en gul farvetone. Ændringen i farve til blå fremhæver tilstedeværelsen af fostervand i vaginalområdet.
Andre anvendelser
Bromothymolblå har også anvendelse i følgende udstyr og funktioner:
-Optiske sensorer
-Systemer til detektion af gasforbrænding
-Ved fremstilling af maling, legetøj, rengøringsmidler, rengøringsmidler og tekstiler
-Sensorer til mad friskhed
-Som et håndtag til frisk og forældet ris
-Ved påvisning af mikroorganismer.
Det bruges også i bakterievækstanalyse, psykoaktive stoffer og dentalmaterialer..
Forberedelse
100 mg bromothymolblåt opløses i 100 ml fortyndet alkohol og filtreres om nødvendigt. Det fremstilles også som følger: 50 mg bromothymolblåt opløses i en blanding af 4 ml 0,02 N natriumhydroxid og 20 ml alkohol, fyldes op til 100 ml med vand.
Referencer
- Wikipedia. (2018). Bromothymolblåt. Gendannet fra: en.wikipedia.org
- Foist L. (2018). Bromothymolblå: definition, anvendelser og formel. Undersøgelse. Gendannet fra: study.com
- Science Company. (2018). Bromothymol blå pH-indikator, 1 oz. Gendannet fra: sciencecompany.com
- Spektrofotometrisk bestemmelse af pK af bromothymolblå indikator. Gendannet fra: fch.upol.cz
- PubChem. (2018). Bromothymol blå. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Royal Society of Chemistry. (2015). Bromothymolblå. ChemSpider. Gendannet fra: chemspider.com
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.



Endnu ingen kommentarer