
Typer af kemiske bindinger

Kemiske bindinger er kræfter, der holder atomer sammen at danne molekylerne. Der er tre typer bindinger mellem atomer:
- Metallisk binding.
- Ionisk binding.
- Kovalent binding: ikke-polær, polær, enkelt, dobbelt, tredobbelt, dativ.
Takket være disse bindinger dannes alle forbindelser, der findes i naturen. Der er også kræfter, der holder molekyler sammen, kendt som intermolekylære bindinger, såsom:
- Brintbindinger eller bindinger.
- Dipole-dipol kræfter.
Dernæst forklarer vi hvert af disse links.
| Typer af kemisk binding | Egenskab | Eksempler | |
|---|---|---|---|
| Metal | Metalioner flyder i et hav af bevægelige elektroner. | Metalliske elementer: natrium, barium, sølv, jern, kobber. | |
| Ionisk | Overførsel af elektroner fra et atom til et andet. | Natriumchlorid Na+Cl- | |
| Kovalent | Ikke polær | Del elektroner ligeligt mellem to atomer. | Molekylært hydrogen H-H eller Hto |
| Polar | Del elektroner ujævnt mellem to atomer. | Vandmolekyle HtoELLER | |
| Enkel | Del et par elektroner. | Klormolekyle Clto Cl-Cl | |
| Dobbelt | Del to par elektroner. | Oxygenmolekyle Oto O = O | |
| Tredobbelt | Del tre par elektroner. | Kvælstofmolekyle N2N eller Nto | |
| Dativ | Kun et af atomerne deler elektronerne. | Binding mellem nitrogen og bor i forbindelsen ammoniak-bornrifluorid. | |
| Intermolekylære kræfter | Brintbro | Hydrogenerne i et molekyle tiltrækkes af de elektronegative atomer i et andet molekyle. | Brint binder mellem brint fra et vandmolekyle med ilt fra et andet vandmolekyle. |
| Dipol-dipol | Molekyler med to elektriske poler tiltrækker de modsatte poler af andre molekyler. | Interaktioner mellem methanal H-molekylertoC = O | |
Metallisk binding
Den metalliske binding er tiltrækningskraften mellem de positive ioner af metalelementerne og de negative elektroner, der bevæger sig frit mellem ionerne. Metalatomer er tæt pakket, hvilket gør det muligt for elektroner at bevæge sig inden i atomgitteret.
I metaller frigøres valenselektronerne fra deres oprindelige atom og danner et "hav" af elektroner, der flyder rundt i hele metalstrukturen. Dette får metalatomer til at transformere sig til positivt ladede metalioner, der pakker sammen..
Den metalliske binding etableres mellem metalliske elementer såsom natrium Na, barium Ba, calcium Ca, magnesium Mg, guld Au, sølv Ag og aluminium Al.
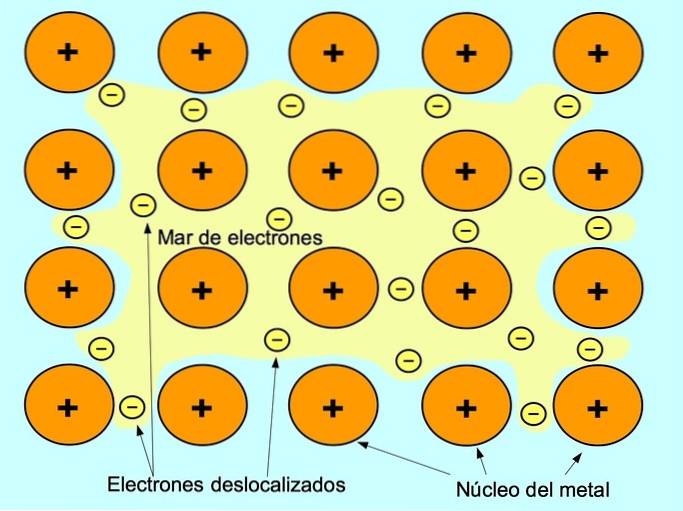
Ionisk binding
Den ioniske binding er den kraft, der forbinder et metalelement, såsom natrium eller magnesium, med et ikke-metallisk element, såsom chlor eller svovl. Metallet mister elektroner og omdannes til en positiv metalion kaldet kation. Disse elektroner overføres til det ikke-metalliske element, og det omdannes til en kaldet negativt ladet ion anion.
Kationerne og anionerne kombinerer og danner et tredimensionelt netværk, der opretholdes af kræfterne i den elektrostatiske tiltrækning mellem ionerne med forskellige ladninger. Disse kræfter danner ioniske forbindelser.
Jordskorpen består hovedsageligt af ioniske forbindelser. De fleste klipper, mineraler og ædelstene er ioniske forbindelser. For eksempel:
- Natriumchlorid NaCl: det metalliske element er natrium, der overfører en elektron til klor, som er det ikke-metalliske element.
- Magnesiumchlorid MgClto: Magnesium Mg donerer to elektroner til to kloratomer, som vist i nedenstående figur:
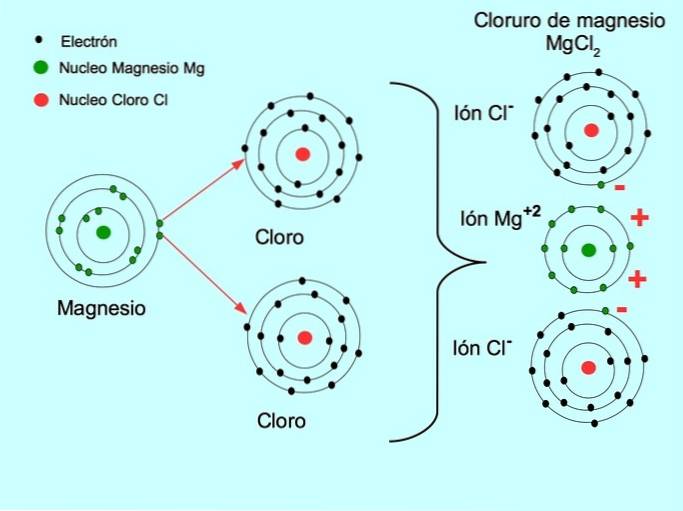
Se også Forskel mellem kationer og anioner.
Kovalent binding
Den kovalente binding dannes, når to ikke-metalliske atomer deler elektroner. Denne binding kan være af flere typer afhængigt af affiniteten for atomernes elektroner og mængden af delte elektroner.
Ikke-polær kovalent binding
Den ikke-polære kovalente binding er den binding, der dannes mellem to atomer, hvor elektroner deles ens. Denne binding forekommer normalt i symmetriske molekyler, dvs. molekyler, der består af to lige atomer, såsom hydrogenmolekylet Hto og iltmolekylet Oto.
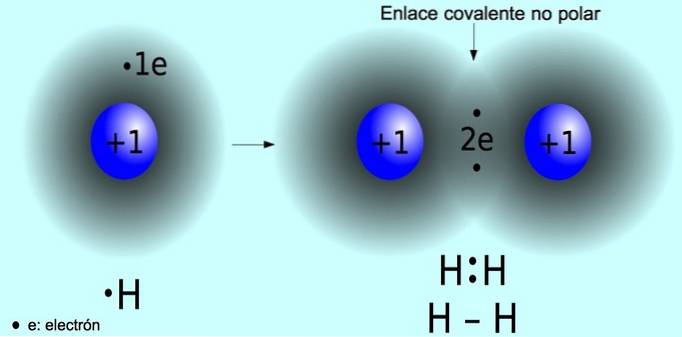
Polær kovalent binding
Den polære kovalente binding dannes, når to atomer deler elektroner, men en af dem har en større tiltrækningskraft for elektroner. Dette får molekylet til at have en mere negativ "pol" med et større antal elektroner, og den modsatte pol er mere positiv..
Molekyler med denne fordeling eller ubalance af elektroner er kendt som polære. For eksempel er der i HF hydrogenfluorid en kovalent binding mellem hydrogen og fluor, men fluor har højere elektronegativitet, så det tiltrækker delte elektroner stærkere..
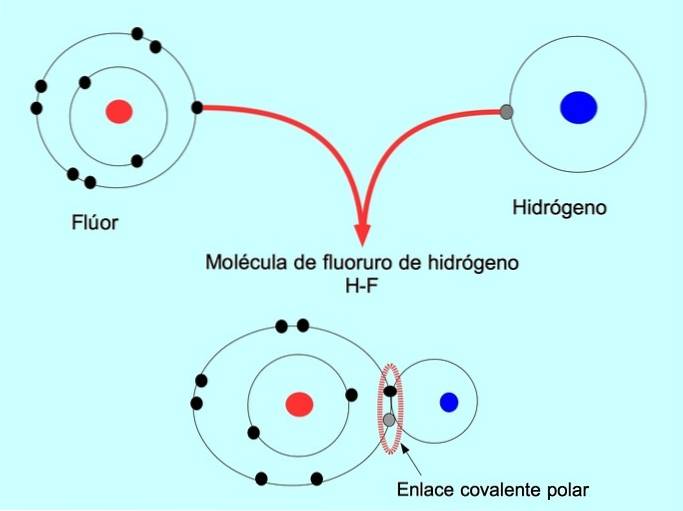
Enkel kovalent binding
Når to atomer deler to elektroner, en fra hver, kaldes den dannede kovalente binding en simpel kovalent binding.
For eksempel er klor et atom, der har syv valenselektroner i sin ydre skal, som kan fyldes med otte elektroner. En klor kan kombineres med en anden klor til dannelse af klormolekylet Clto hvilket er meget mere stabilt end klor alene.
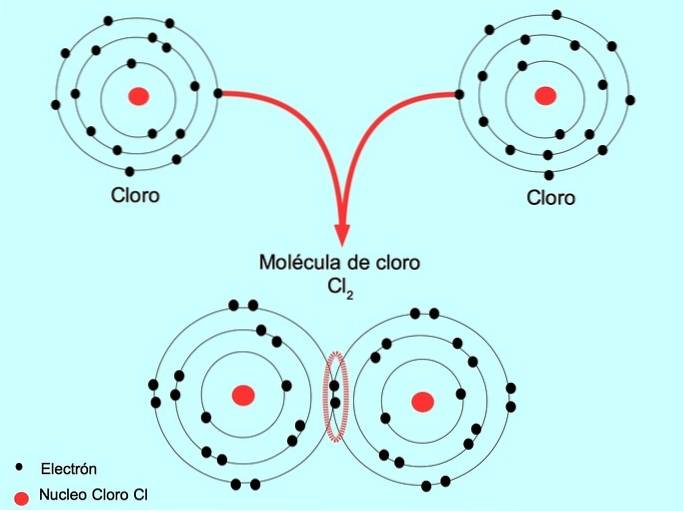
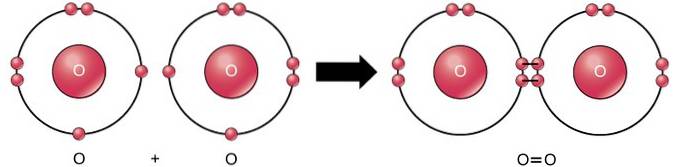
Dobbelt kovalent binding
Den dobbelte kovalente binding er bindingen, hvor fire elektroner (to par) elektroner deles mellem to atomer. For eksempel har ilt 6 elektroner i sin sidste skal. Når to oxygener kombineres, deles fire elektroner mellem de to, hvilket får hver til at have 8 elektroner i den sidste skal..
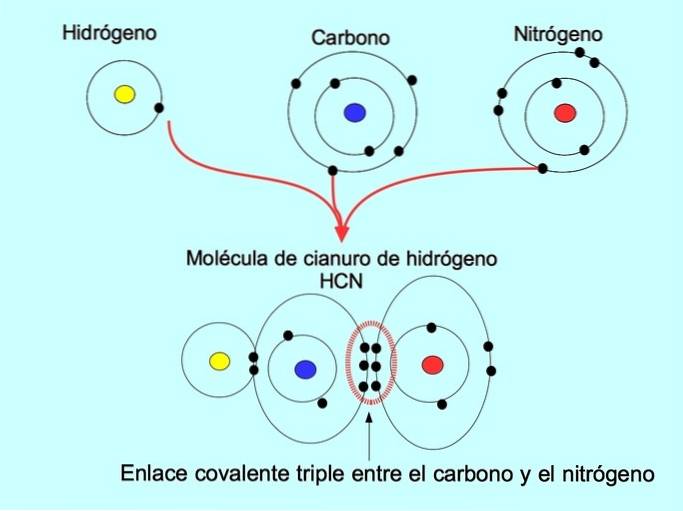
Triple kovalent binding
Den tredobbelte kovalente binding dannes, når 6 elektroner (eller tre par) deles mellem to atomer. For eksempel dannes der i hydrogencyanidmolekylet HCN en tredobbelt binding mellem kulstof og nitrogen som vist i nedenstående figur:
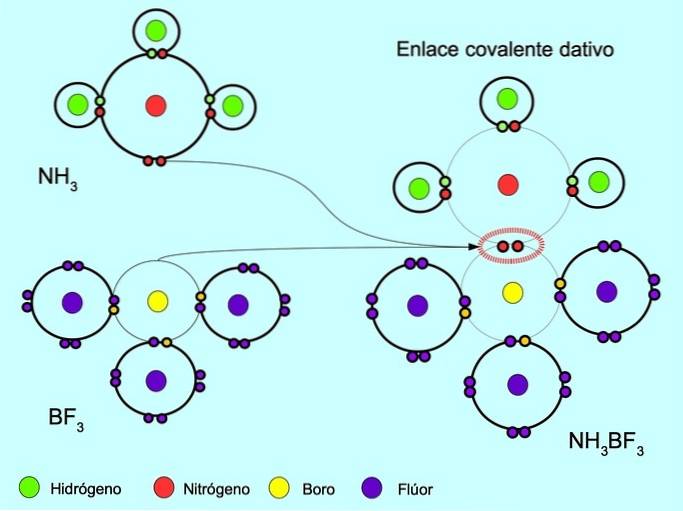
Koordinat eller dativ kovalent binding
Den koordinerede eller dative kovalente binding er den binding, der dannes, når kun et af atomerne i bindingen bidrager med et par elektroner. For eksempel når ammoniak NH reagerer3 med bortrifluorid BF3, Kvælstofbindinger med to elektroner direkte til bor, som ikke har nogen elektroner til rådighed til at dele. På denne måde efterlades både nitrogen og bor med 8 elektroner i deres valensskal..
Se også organiske og uorganiske forbindelser.
Intermolekylære links
Molekyler associeres gennem kræfter, der gør det muligt at danne stoffer i flydende eller fast tilstand.
Dipol-dipolbindinger eller kræfter
Svage intermolekylære bindinger kan etableres mellem polære molekyler, når negative poler tiltrækkes af positive poler og omvendt. For eksempel methanal HtoC = O er et polært molekyle med en delvis negativ ladning på ilt og en delvis positiv ladning på hydrogener. Den positive side af et methanalmolekyle tiltrækker den negative side af et andet methanalmolekyle.
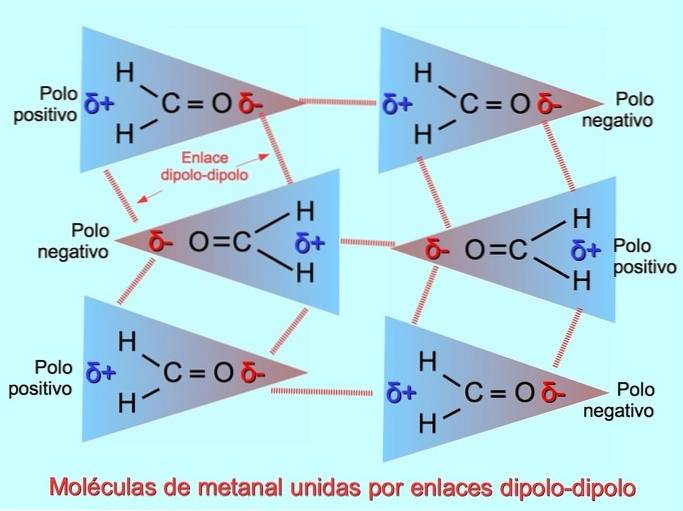
Brintbindinger eller bindinger
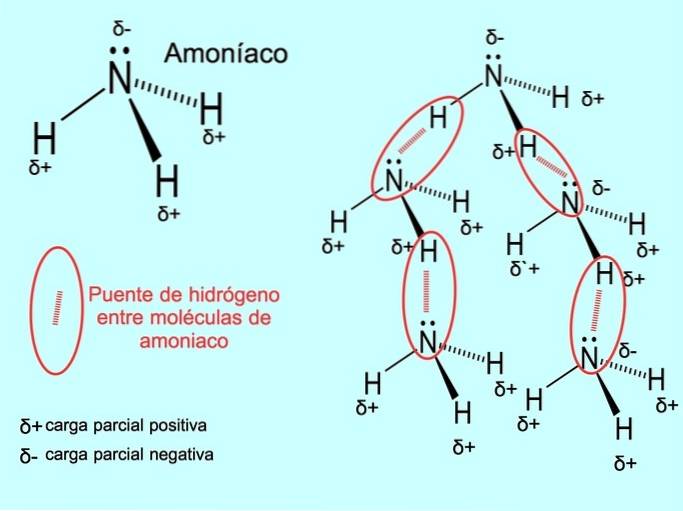
Hydrogenbindingen eller hydrogenbindingen er en binding, der etableres mellem molekyler. Det sker, når et brint i molekylet er kovalent bundet til et ilt, et nitrogen eller en fluor. Oxygen, nitrogen og fluor er atomer med højere elektronegativitet, derfor tiltrækker de elektroner stærkere, når de deler dem med et andet mindre elektronegativt atom..
Der er hydrogenbindinger mellem vandmolekyler HtoO- og NH-ammoniak3 som billedet viser:
Du kan være interesseret i at se:
- Atomer og molekyler.
- Eksempler på organiske og uorganiske forbindelser.
Referencer
Zumdahl, S.S., Zumdahl, S.A. (2014) Kemi. Niende udgave. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5. udgave. Pearson Australien. Melbourne.

Endnu ingen kommentarer