
Svovltrioxid (SO3) struktur, egenskaber, risici, anvendelser

Det svovltrioxid Det er en uorganisk forbindelse dannet ved foreningen af et svovlatom (S) og 3 oxygenatomer (O). Dens molekylformel er SO3. Ved stuetemperatur, SO3 det er en væske, der frigiver gasser i luften.
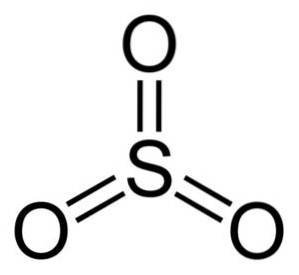
OS-strukturen3 gasformig er flad og symmetrisk. Alle tre oxygener er lige placeret omkring svovl. SO3 Reagerer voldsomt med vand. Reaktionen er eksoterm, hvilket betyder, at der produceres varme, med andre ord bliver den meget varm.
Når SO3 væske afkøles, bliver til et fast stof, der kan have tre typer struktur: alfa, beta og gamma. Den mest stabile er alfa i form af lag, der er sammenføjet og udgør et netværk.
Gasformig svoveltrioxid bruges til at fremstille røgende svovlsyre, også kaldet oleum, på grund af dets lighed med olie eller olieagtige stoffer. En anden af dens vigtige anvendelser er sulfonering af organiske forbindelser, dvs. tilsætning af -SO-grupper3- til disse. Således kan nyttige kemikalier, såsom detergenter, farvestoffer, pesticider, blandt mange andre fremstilles..
SO3 Det er meget farligt, det kan forårsage alvorlige forbrændinger, øjen- og hudskader. Det skal heller ikke inhaleres eller indtages, da det kan forårsage død ved indre forbrændinger, i munden, spiserøret, maven osv..
Af disse grunde skal det håndteres med stor forsigtighed. Det bør aldrig komme i kontakt med vand eller brændbare materialer som træ, papir, stoffer osv., Da der kan opstå brande. Den må hverken bortskaffes eller komme i kloak på grund af eksplosionsfare.
SO3 Gasformet dannet i industrielle processer bør ikke frigives i miljøet, da det er en af dem, der er ansvarlige for den sure regn, der allerede har beskadiget store skovområder i verden.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tredobbelt punkt
- 3.5 Kogepunkt
- 3.6 Tæthed
- 3.7 Damptryk
- 3.8 Stabilitet
- 4 Kemiske egenskaber
- 5 Opnåelse
- 6 anvendelser
- 6.1 Ved fremstilling af oleum
- 6.2 Ved sulfonering kemiske reaktioner
- 6.3 Ved ekstraktion af metaller
- 6.4 I forskellige anvendelser
- 7 risici
- 7.1 For sundheden
- 7.2 Fra brand eller eksplosion
- 8 Miljøpåvirkning
- 9 Referencer
Struktur
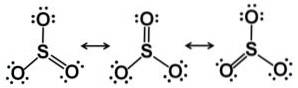
Svoveltrioxidmolekylet SO3 i gasform har den en flad trekantet struktur.
Dette betyder, at både svovl og de tre oxygener er i samme plan. Desuden er fordelingen af oxygener og alle elektroner symmetrisk.
I fast tilstand kendes tre typer struktur af SO3: alfa (α-SO3), beta (β-SO3) og gamma (γ-SO3).
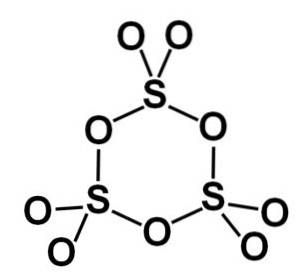
Gamma γ-SO form3 indeholder cykliske trimere, det vil sige tre enheder af SO3 danner sammen et cyklisk eller ringformet molekyle.
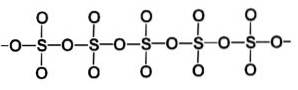
Betafasen β-SO3 besidder uendelige spiralformede kæder af tetraeder med sammensætning SO4 bundet sammen.
Den mest stabile form er alfa α-SO3, ligner beta, men med en lagdelt struktur, hvor kæderne er forbundet til et netværk.
Nomenklatur
-Svovltrioxid
-Svovlsyreanhydrid
-Svovloxid
-SW3 gamma, γ-SO3
-SW3 beta, β-SO3
-SW3 alfa, a-SO3
Fysiske egenskaber
Fysisk tilstand
Ved stuetemperatur (ca. 25 ºC) og atmosfærisk tryk, SO3 det er en farveløs væske, der udsender røg i luften.
Når SO3 væske er ren ved 25 ºC, det er en blanding af SO3 monomer (enkelt molekyle) og trimer (3 molekyler vedhæftet) med formlen S3ELLER9, også kaldet SO3 gamma γ-SO3.
Når temperaturen falder, hvis SO3 den er ren, når den når 16,86 ºC, den stivner eller fryser til γ-SO3, også kaldet "SO is3".
Hvis den indeholder små mængder fugt (endda spor eller ekstremt små mængder) SO3 polymeriserer til beta β-SO-form3 som danner krystaller med en silkeagtig glans.
Derefter dannes flere bindinger, der genererer alfa α-SO-strukturen3, som er et nåleformet krystallinsk fast stof, der ligner asbest eller asbest.
Når alfa og beta smelter sammen, genererer de gamma.
Molekylær vægt
80,07 g / mol
Smeltepunkt
SW3 gamma = 16,86 ºC
Triple point
Det er temperaturen, hvor de tre fysiske tilstande er til stede: fast stof, væske og gas. I alfa-form er det tredobbelte punkt ved 62,2 ° C, og i beta er det ved 32,5 ° C.
Opvarmning af alfa-form har en større tendens til at sublimere end at smelte. Sublimat betyder at gå direkte fra fast tilstand til gasform uden at gå gennem flydende tilstand.
Kogepunkt
Alle former for OS3 kog ved 44,8 ºC.
Massefylde
SO3 væske (gamma) har en densitet på 1,9225 g / cm33 ved 20 ºC.
SO3 gasformig har en densitet på 2,76 i forhold til luft (luft = 1), hvilket indikerer at den er tungere end luft.
Damptryk
SW3 alfa = 73 mm Hg ved 25 ºC
SW3 beta = 344 mm Hg ved 25 ºC
SW3 gamma = 433 mm Hg ved 25 ºC
Dette betyder, at gamma-formen har en tendens til at fordampe lettere end beta og dette end alfa..
Stabilitet
Alfa-formen er den mest stabile struktur, de andre er metastabile, det vil sige de er mindre stabile.
Kemiske egenskaber
SO3 reagerer kraftigt med vand for at give svovlsyre HtoSW4. Ved reaktion produceres der meget varme, hvorfor der hurtigt frigøres vanddamp fra blandingen.
At blive udsat for luften SO3 absorberer fugt hurtigt og udsender tætte dampe.
Det er et meget stærkt dehydratiseringsmiddel, det betyder, at det let fjerner vand fra andre materialer.
Svovl i SO3 har en affinitet for frie elektroner (dvs. elektroner, der ikke er i en binding mellem to atomer), så det har tendens til at danne komplekser med forbindelser, der besidder dem, såsom pyridin, trimethylamin eller dioxan.
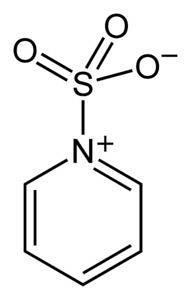
Ved at danne komplekser "låner" svovl elektroner fra den anden forbindelse for at udfylde dens mangel på dem. Svovltrioxid er stadig tilgængelig i disse komplekser, som anvendes i kemiske reaktioner for at tilvejebringe SO3.
Det er et stærkt sulfonantreagens til organiske forbindelser, hvilket betyder, at det bruges til let at tilføje en -SO-gruppe3- til molekyler.
Reagerer let med oxider af mange metaller for at give sulfater af disse metaller.
Det er ætsende for metaller, animalsk og plantevæv.
SO3 Det er et vanskeligt materiale at håndtere af flere årsager: (1) dets kogepunkt er relativt lavt, (2) det har en tendens til at danne faste polymerer ved temperaturer under 30 ºC og (3) det har en høj reaktivitet over for næsten alle organiske stoffer og vandet.
Det kan polymerisere eksplosivt, hvis det ikke indeholder en stabilisator, og der er fugt. Dimethylsulfat eller boroxid anvendes som stabilisatorer..
Opnåelse
Det opnås ved reaktion ved 400 ºC mellem svovldioxid SOto og molekylært ilt Oto. Imidlertid er reaktionen meget langsom, og katalysatorer kræves for at øge reaktionshastigheden..
2 SÅto + ELLERto SO 2 SO3
Blandt de forbindelser, der fremskynder denne reaktion, er platinmetallet Pt, vanadiumpentoxid VtoELLER5, jernoxid FetoELLER3 og nitrogenoxid NO.
Ansøgninger
Ved forberedelse af oleum
En af dens vigtigste anvendelser er fremstillingen af oleum eller svovlsyre, der kaldes, fordi det udsender dampe, der er synlige for det blotte øje. For at opnå det absorberes SO3 i koncentreret svovlsyre HtoSW4.

Dette gøres i specielle tårne i rustfrit stål, hvor den koncentrerede svovlsyre (som er flydende) går ned og SO3 sodavand stiger.
Væsken og gassen kommer i kontakt og kommer sammen og danner oleum, som er en olieagtig væske. Dette besidder en blanding af HtoSW4 Også3, men det har også svovlsyre-molekyler HtoStoELLER7 og trisulfurisk HtoS3ELLER10.
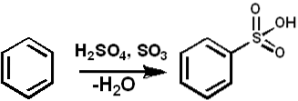
Ved sulfonerings kemiske reaktioner
Sulfonering er en nøgleproces i store industrielle applikationer til fremstilling af vaskemidler, overfladeaktive stoffer, farvestoffer, pesticider og lægemidler..
SO3 det tjener som et sulfoneringsmiddel til fremstilling af sulfonerede olier og alkyl-aryl-sulfonerede detergenter blandt mange andre forbindelser. Følgende viser sulfoneringsreaktionen af en aromatisk forbindelse:
ArH + SO3 → ArSO3H
Oleum eller SO kan bruges til sulfoneringsreaktioner.3 i form af dets komplekser med blandt andre pyridin eller med trimethylamin.
Ved udvinding af metaller
SÅ gas3 Det er blevet brugt til behandling af mineraler. Enkle oxider af metaller kan blive meget mere opløselige sulfater ved at behandle dem med SO3 ved relativt lave temperaturer.
Sulfidmineraler såsom pyrit (jernsulfid), chalcosin (kobbersulfid) og millerit (nikkelsulfid) er de mest økonomiske kilder til ikke-jernholdige metaller, så behandling med SO3 gør det muligt at opnå disse metaller let og til lave omkostninger.
Jern, nikkel og kobbersulfider reagerer med SO-gas3 selv ved stuetemperatur danner de respektive sulfater, som er meget opløselige og kan udsættes for andre processer for at opnå det rene metal.
I forskellige anvendelser
SO3 bruges til at fremstille chlorsvovlsyre også kaldet chlorsulfonsyre HSO3Cl.
Svovltrioxid er en meget kraftig oxidant og bruges til fremstilling af sprængstoffer..
Risici
Til helbredet
SO3 Det er en meget giftig forbindelse ad alle veje, dvs. indånding, indtagelse og kontakt med huden.
Irriterende og korroderende slimhinder. Forårsager forbrændinger af hud og øjne. Dampene er meget giftige ved indånding. Indvendige forbrændinger, åndenød, brystsmerter og lungeødem.

Det er giftigt. Indtagelsen genererer alvorlige forbrændinger i munden, spiserøret og maven. Derudover mistænkes det for at være kræftfremkaldende.
Fra brand eller eksplosion
Det udgør en brandfare ved kontakt med materialer af organisk oprindelse som træ, fibre, papir, olie, bomuld, blandt andre, især hvis de er våde..
Der er også en risiko, hvis du kommer i kontakt med baser eller reduktionsmidler. Kombineres eksplosivt med vand og danner svovlsyre.
Kontakt med metaller kan producere brintgas Hto hvilket er meget brandfarligt.
Opvarmning i glasbeholdere bør undgås for at forhindre mulig voldsom brud på beholderen..
Miljømæssig påvirkning
SO3 Det betragtes som et af de største forurenende stoffer, der findes i jordens atmosfære. Dette skyldes dets rolle i dannelsen af aerosoler og dets bidrag til sur regn (på grund af dannelsen af svovlsyre HtoSW4).

SO3 dannes i atmosfæren ved oxidation af svovldioxid SOto. Ved dannelse af SO3 den reagerer hurtigt med vand til dannelse af svovlsyre HtoSW4. Ifølge nylige undersøgelser er der andre mekanismer til transformation af SO3 i atmosfæren, men på grund af den store mængde vand, der findes i den, anses det stadig for meget mere sandsynligt, at SO3 bliver primært HtoSW4.
SO3 Gas eller gasformigt industriaffald, der indeholder det, bør ikke udledes i atmosfæren, da det er et farligt forurenende stof. Det er en meget reaktiv gas, og som allerede nævnt før, i nærværelse af fugt i luften, SO3 bliver svovlsyre HtoSW4. Derfor i luften SO3 vedvarer i form af svovlsyre, der danner små dråber eller aerosol.
Hvis svovlsyredråberne kommer ind i luftvejene hos mennesker eller dyr, vokser de hurtigt i størrelse på grund af fugtigheden der, så de har en chance for at trænge ind i lungerne. En af de mekanismer, hvormed syretågen af HtoSW4 (dvs. SO3) kan producere stærk toksicitet, fordi det ændrer den ekstracellulære og intracellulære pH i levende organismer (planter, dyr og mennesker).
Ifølge nogle forskere, tåge fra SO3 Det er årsagen til stigningen i astmatikere i et område i Japan. SÅ tåge3 Det har en meget ætsende virkning over for metaller, så metalstrukturer bygget af mennesker, såsom nogle broer og bygninger, kan blive hårdt ramt..
SO3 Væske bør ikke bortskaffes i kloakafløb eller kloakker. Hvis det spildes i kloakker, kan det medføre brand eller eksplosion. Ret ikke en vandstrøm mod produktet, hvis det spildes ved et uheld. Det bør aldrig absorberes i savsmuld eller andet brændbart absorberende middel, da det kan forårsage brande.
Det skal absorberes i tørt sand, tør jord eller andet helt tørt inaktivt absorberende middel. SO3 Det bør ikke frigives i miljøet, og det bør aldrig få lov til at komme i kontakt med det. Det skal holdes væk fra vandkilder, fordi det med dette producerer svovlsyre, der er skadeligt for organismer, der lever i vand og jord.
Referencer
- Sarkar, S. et al. (2019). Indflydelse af ammoniak og vand på skæbnen til svovltrioxid i troposfæren: Teoretisk undersøgelse af sulfaminsyre og svovlsyredannelsesveje. J Phys Chem A. 2019; 123 (14): 3131-3141. Gendannet fra ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Svovlsyre og svovltrioxid. Kirk-Othmer Encyclopedia of Chemical Technology. Bind 23. Gendannet fra onlinelibrary.wiley.com.
- OS. National Library of Medicine. (2019). Svovltrioxid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Miljøstyring af svovltrioxidemission: Virkning af SO3 om menneskers sundhed. Miljøledelse (2001) 27: 837. Gendannet fra link.springer.com.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Ismail, M.I. (1979). Ekstraktion af metaller fra sulfider ved anvendelse af svovltrioxid i fluidiseret seng. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Gendannet fra onlinelibrary.wiley.com.



Endnu ingen kommentarer