
Arsen historie, struktur, egenskaber, anvendelser
Det arsen Det er en semimetal eller metalloid, der hører til gruppe 15 eller VA i det periodiske system. Det er repræsenteret af det kemiske symbol As, og dets atomnummer er 33. Det kan findes i tre allotrope former: gul, sort og grå; sidstnævnte er den eneste med industriel betydning.
Grå arsen er et sprødt, metallisk udseende fast stof med en stål, krystallinsk farve (billedet nedenfor). Det mister sin glans, når det udsættes for luft og danner arsenoxid (AstoELLER3), som ved opvarmning udsender en hvidløgslugt. På den anden side er dens gule og sorte allotroper henholdsvis molekylære og amorfe..

Arsen findes i jordskorpen forbundet med adskillige mineraler. Kun en lille del findes i den oprindelige stat, men forbundet med antimon og sølv.
Blandt de mest almindelige mineraler, hvori arsen findes, er følgende: realgar (As4S4), orpimentet (AstoS3), loellingite (FeAsto) og enargit (Cu3AsS4). Arsen opnås også som et biprodukt ved smeltning af metaller som bly, kobber, cobalt og guld..
Arsenforbindelser er giftige, især arsin (AsH3). Imidlertid har arsen adskillige industrielle anvendelser, herunder legering med bly, der anvendes til fremstilling af bilbatterier og legering med gallium med forskellige anvendelser inden for elektronik..
Artikelindeks
- 1 Historie om dets opdagelse
- 2 Struktur af arsen
- 2.1 Gul arsen
- 2.2 Sort arsen
- 3 Elektronisk konfiguration
- 4 egenskaber
- 4.1 Molekylvægt
- 4.2 Fysisk beskrivelse
- 4.3 Farve
- 4.4 Lugt
- 4.5 Smag
- 4.6 Smeltepunkt
- 4.7 Tæthed
- 4.8 Opløselighed i vand
- 4.9 Atomeradius
- 4.10 Atomvolumen
- 4.11 Kovalent radius
- 4.12 Specifik varme
- 4.13 Fordampningsvarme
- 4.14 Elektronegativitet
- 4.15 Ioniseringsenergi
- 4.16 oxidationstilstande
- 4.17 Stabilitet
- 4.18 Nedbrydning
- 4.19 Selvantændelse
- 4.20 Hårdhed
- 4.21 Reaktivitet
- 5 anvendelser
- 5.1 Legeringer
- 5.2 Elektronik
- 5.3 Landbrug og træbeskyttelse
- 5.4 Lægemidler
- 5.5 Andre anvendelser
- 6 Hvor er?
- 7 Hvordan får du det?
- 8 Referencer
Historie om dets opdagelse
Navnet 'arsen' kommer fra det latinske arsenicum og den græske arsenikon, der henviser til gul orpiment, som var den vigtigste form for brug af arsen af alkymister.
Arsen, længe før det blev anerkendt som et kemisk element, var kendt og anvendt i form af dets forbindelser. For eksempel Aristoteles i det 4. århundrede f.Kr. skrev om sandarache, et stof, der nu menes at være arsensulfid.
Plinius den ældre og Pedanius Discórides beskrev i det 1. århundrede e.Kr. orpiment, et mineral bestående af AstoS3. I det 11. århundrede blev tre arter af arsen anerkendt: hvid (As4ELLER4), den gule (AstoS3) og rød (som4S4).
Arsen som et rent element blev først observeret af Albertus Magnus (1250). Magnus opvarmede arsen sulfid med sæbe og bemærkede udseendet af et stof med en egenskab svarende til den gråligototrop i billedet. Den første autentiske rapport om hans isolation blev imidlertid offentliggjort i 1649 af en tysk farmaceut Johann Schroeder..
Schroeder forberedte arsenet ved at opvarme dets oxid med trækul. Efterfølgende lykkedes det Nicolas Lémery at producere det ved at opvarme en blanding af arsenoxid, sæbe og kaliumchlorid. I det 18. århundrede blev dette element endelig anerkendt som et semi-metal.
Struktur af arsen
Arsen er isomorf til antimon; de er strukturelt identiske og adskiller sig kun i størrelsen på deres atomer. Hvert arsenatom danner tre kovalente bindinger As-As på en sådan måde, at de stammer fra sekskantede enheder As6 “Rynket eller stejlt”, da hybridiseringen af As-atomerne er sp3.
Derefter blev enhederne As6 de forbinder og giver anledning til rene lag af arsen, der interagerer svagt med hinanden. På grund af deres intermolekylære kræfter, der først og fremmest afhænger af deres atommasser, giver rombohedrale grå arsenkrystaller det faste stof en skrøbelig og skør tekstur..
Muligvis på grund af frastødninger af det frie elektronpar arsen, As6 dannet mellem parallelle lag definerer ikke en perfekt men forvrænget oktaeder:
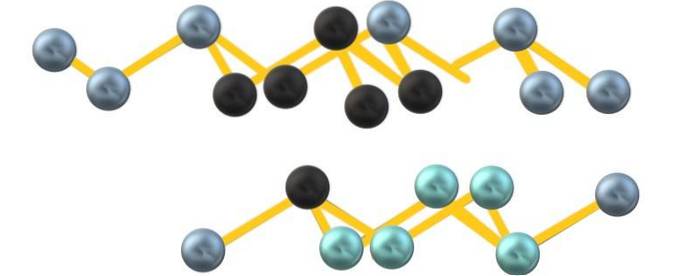
Bemærk, at de sorte kugler tegner det forvrængede plan i rummet mellem to stejle lag. Ligeledes er der i laget nedenunder blålig kugler, der sammen med den sorte kugle udgør enheden som6 nævnt i begyndelsen af afsnittet.
Strukturen ser ordnet ud, rækkerne går op og ned, og derfor er den krystallinsk. Det kan dog blive amorf med kugler presset på forskellige måder. Når grålig arsen bliver amorf, omdannes det til en halvleder.
Gul arsen
Gul arsen, den mest giftige allotrop i dette element, er et rent molekylært fast stof. Den består af molekyler af As4 enheder ved svage spredningskræfter, som ikke forhindrer dem i at fordampe.
Sort arsen
Sort arsen er amorf; men ikke hvordan den grålige allotrop kan være. Dens struktur er lidt lig den, der netop er beskrevet, med forskellen, at dens plan af enheder As6 har større områder og forskellige mønstre af rod.
Elektronisk konfiguration
[Ar] 3d104sto4p3
Det har alle niveau 3 orbitaler fyldt. Danner obligationer ved hjælp af 4s og 4p orbitaler (ligesom 4d) gennem forskellige kemiske hybridiseringer.
Ejendomme
Molekylær vægt
74,922 g / mol
Fysisk beskrivelse
Grå arsen er et gråagtigt fast stof med et metallisk udseende og en sprød konsistens..
Farve
Tre allotrope former, gul (alfa), sort (beta) og grå (gamma).
Lugt
Toilet
Smag
Smagløs
Smeltepunkt
1.090 K ved 35,8 atm (tredobbelt punkt af arsen).
Ved normalt tryk har det intet smeltepunkt, da det sublimerer til 887 K.
Massefylde
-Grå arsen: 5,73 g / cm3.
-Gul arsen: 1,97 g / cm3.
Vandopløselighed
Uopløselig
Atomic radio
Kl
Atomisk volumen
13,1 cm3/ mol
Kovalent radius
120.00
Specifik varme
0,328 J / gmol ved 20 ° C
Fordampningsvarme
32,4 kJ / mol
Elektronegativitet
2.18 på Pauling-skalaen
Ioniseringsenergi
Første ioniseringsenergi 946,2 kJ / mol
Oxidationstilstande
-3, +3, +5
Stabilitet
Elementært arsen er stabilt i tør luft, men når det udsættes for fugtig luft, bliver det dækket af et bronzegult lag, der kan blive et sort lag af arsenoxid (somtoELLER3).
Nedbrydning
Når arsen opvarmes til nedbrydning, udsender det hvid røg fra AstoELLER3. Proceduren er farlig, fordi arsine, en meget giftig gas, også kan frigives.
Selvantændelse
180 ºC
Hårdhed
3.5 på Mohs hårdhedsskala.
Reaktivitet
Det angribes ikke af kold svovlsyre eller koncentreret saltsyre. Reagerer med varm salpetersyre eller svovlsyre og danner arsen og arsen.
Når grå arsen er fordampet ved opvarmning, og dampene hurtigt afkøles, dannes der en gul arsen. Dette vender tilbage til den grålige form, når den udsættes for ultraviolet lys.
Ansøgninger
Legeringer
En lille mængde arsen tilsat til bly hærder legeringerne nok til at bruge dem til belægning af kabler og til fremstilling af bilbatterier..
Tilsætningen af arsen til messing, en legering af kobber og zink, øger dets modstandsdygtighed over for korrosion. På den anden side korrigerer eller reducerer det tabet af zink i messingen, hvilket medfører en forøgelse af dets levetid..
elektronik
Oprenset arsen anvendes i halvlederteknologi, hvor det anvendes i forbindelse med gallium og germanium såvel som i form af galliumarsenid (GaAs), som er den næstmest anvendte halvleder.
GaA'er har et direkte båndgab, som kan bruges i diode-, laser- og LED-fremstilling. Ud over galliumarsenid er der andre arsenider, såsom indiumarsenid og aluminiumarsenid, som også er III-V halvledere..
I mellemtiden er cadmiumarsenid en type II-IV halvleder. Arsine er blevet brugt til halvlederdoping.
Landbrug og træbeskyttelse
De fleste af applikationerne er blevet skrottet på grund af deres høje toksicitet og deres forbindelser. EssettoELLER3 er blevet brugt som et pesticid, mens AstoELLER5 er en ingrediens i herbicider og insekticider.
Arseninsyre (H3AsO4) og salte, såsom calciumarsenat og blyarsenat, er blevet anvendt til sterilisering af jord og bekæmpelse af skadedyr. Dette skaber en risiko for miljøforurening med arsen..
Blyarsenat blev brugt som insekticid på frugttræer indtil første halvdel af det 20. århundrede. Men på grund af dets toksicitet blev det erstattet af natriummethylarsenat, som stoppede med at blive brugt af samme grund siden 2013.
Medicinsk
Indtil det 20. århundrede blev flere af dets forbindelser brugt som medicin. Arsphenamin og neolsalvarsan er for eksempel blevet brugt til behandling af syfilis og trypanosomiasis.
I 2000 blev brugen af AstoELLER3, Meget giftig forbindelse til behandling af akut promyelocytisk leukæmi, der er resistent over for all-trans retinsyre. For nylig blev den radioaktive isotop anvendt 74Es til tumorlokalisering.
Isotopen giver gode billeder, klarere end dem, der opnås med 124Jeg, fordi jod føres til skjoldbruskkirtlen og producerer støj i signalet.
Andre anvendelser
Arsen blev tidligere brugt som fodertilsætningsstof i fjerkræ- og svineproduktion.
Det bruges som en katalysator til fremstilling af ethylenoxid. Det bruges også i fyrværkeri og garvning. Arsenoxid anvendes som affarvningsmiddel ved fremstilling af glas.
Hvor er det placeret?
Arsen kan findes i små mængder i elementær tilstand med en høj grad af renhed. Det er til stede i adskillige forbindelser, såsom: sulfider, arsenider og sulfoarseniider.
Det findes også i flere mineraler, herunder: arsenopyrit (FeSAs), loellingite (FeAs)to), enargit (Cu3AsS4), orpimentet (AstoS3) og realgar (As4S4).
Hvordan opnås det?
Arsenopyrit opvarmes til 650-700 ° C i fravær af luft. Arsenet fordamper og efterlader jernsulfid (FeS) som en rest. Under denne proces forbinder arsen ilt til dannelse af As4ELLER6, kendt som "hvid arsen".
Esset4ELLER6 er modificeret til at danne AstoELLER3, hvis dampe samles og kondenseres i et sæt murstenkamre, hvor arsenen renses ved sublimering.
Det meste af arsenet produceres ved reduktion med kulstof af det støv, der dannes fra AstoELLER3.
Referencer
- Stephen R. Marsden. (23. april 2019). Kemi af arsen. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (3. december 2018). Interessante fakta om arsen. Gendannet fra: thoughtco.com
- Wikipedia. (2019). Arsen. Gendannet fra: en.wikipedia.org
- Dr. Dough Stewart. (2019). Fakta om arsenelement. Chemicool. Gendannet fra: chemicool.com
- Royal Society of Chemistry. (2019). Arsen. Gendannet fra: rsc.or
- Redaktørerne af Encyclopaedia Britannica. (3. maj 2019). Arsen. Encyclopædia Britannica. Gendannet fra: britannica.com



Endnu ingen kommentarer