
Nitrogen Valences-konfiguration og forbindelser

Det kvælstofvalenser De spænder fra -3, som i ammoniak og aminer, til +5 som i salpetersyre (Tyagi, 2009). Dette element udvider ikke valenser som andre.
Nitrogenatomet er et kemisk element med atomnummer 7 og det første element i gruppe 15 (tidligere VA) i det periodiske system. Gruppen består af nitrogen (N), fosfor (P), arsen (As), antimon (Sb), vismut (Bi) og moscovium (Mc).

Elementerne deler visse generelle ligheder i kemisk adfærd, skønt de er klart forskellige fra hinanden kemisk. Disse ligheder afspejler fælles egenskaber ved de elektroniske strukturer for deres atomer (Sanderson, 2016).
Kvælstof er til stede i næsten alle proteiner og spiller en vigtig rolle i både biokemiske og industrielle applikationer. Kvælstof danner stærke bindinger på grund af dets evne til at danne en tredobbelt binding med et andet nitrogenatom og andre grundstoffer..
Derfor er der en stor mængde energi i nitrogenforbindelser. Før 100 år siden vidste man ikke meget om kvælstof. Nu anvendes nitrogen ofte til konservering af mad og som gødning (Wandell, 2016).
Elektronisk konfiguration og valenser
I et atom fylder elektronerne de forskellige niveauer i henhold til deres energi. De første elektroner fylder de lavere energiniveauer og flytter sig derefter til et højere energiniveau.
Det yderste energiniveau i et atom er kendt som valensskallen, og elektronerne placeret i denne skal kaldes valenselektroner..
Disse elektroner findes hovedsageligt i bindingsdannelse og kemisk reaktion med andre atomer. Derfor er valenselektroner ansvarlige for forskellige grundlæggende kemiske og fysiske egenskaber (Valence Electron, S.F.).
Kvælstof har som nævnt et atomnummer på Z = 7. Dette indebærer, at dets fyldning af elektroner i deres energiniveauer eller elektronkonfiguration er 1Sto 2Sto 2 s3.
Det skal huskes, at atomer i naturen altid søger at have den elektroniske konfiguration af ædelgasser, enten ved at vinde, miste eller dele elektroner..
I tilfælde af nitrogen er den ædle gas, der søger at have en elektronisk konfiguration, neon, hvis atomnummer er Z = 10 (1Sto 2Sto 2 s6) og helium, hvis atomnummer er Z = 2 (1Sto) (Reusch, 2013).
De forskellige måder, hvorpå kvælstof skal kombineres, giver det dets valens (eller oxidationstilstand). I det specifikke tilfælde af nitrogen, fordi det er i den anden periode i det periodiske system, er det ude af stand til at udvide sin valensskal, som de andre elementer i sin gruppe gør..
Det forventes at have valenser på -3, +3 og +5. Imidlertid har kvælstof valenstilstande, der spænder fra -3, som i ammoniak og aminer, til +5, som i salpetersyre. (Tyagi, 2009).
Valensbindingsteorien hjælper med at forklare dannelsen af forbindelser i henhold til elektronkonfigurationen af nitrogen for en given oxidationstilstand. Til dette er det nødvendigt at tage højde for antallet af elektroner i valensskallen, og hvor meget der er tilbage for at erhverve ædelgaskonfigurationen..
Kvælstofforbindelser
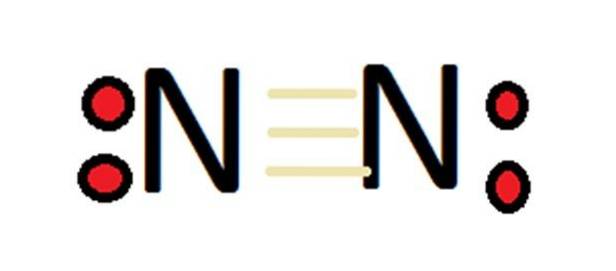
På grund af dets store antal oxidationstilstande kan nitrogen danne et stort antal forbindelser. I første omgang skal det huskes, at i tilfælde af molekylært nitrogen er valensen pr. Definition 0.
Oxidationstilstanden -3 er en af de mest almindelige for elementet. Eksempler på forbindelser med denne oxidationstilstand er ammoniak (NH3), aminer (R3N), ammoniumion (NH4+), iminer (C = N-R) og nitriler (C2N).
I oxidationstilstand -2 er nitrogen tilbage med 7 elektroner i sin valensskal. Dette ulige antal elektroner i valensskallen forklarer, hvorfor forbindelser med denne oxidationstilstand har en broforbindelse mellem to nitrogen. Eksempler på forbindelser med denne oxidationstilstand er hydraziner (Rto-N-N-Rtoog hydrazoner (C = N-N-Rto).
I -1 oxidationstilstand er der nitrogen tilbage med 6 elektroner i valensskallen. Eksempel på nitrogenforbindelser med denne valens er hydroxylamin (RtoNOH) og azoforbindelserne (RN = NR).
I positive oxidationstilstande er nitrogen generelt bundet til iltatomer for at danne oxider, oxysalte eller oxacider. I tilfælde af +1 oxidationstilstand har nitrogen 4 elektroner i sin valensskal.
Eksempler på forbindelser med denne valens er dinitrogenoxid eller lattergas (NtoO) og nitrosoforbindelser (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
I tilfælde af oxidationstilstanden på +2 er et eksempel nitrogenoxid eller nitrogenoxid (NO), en farveløs gas produceret ved omsætning af metaller med fortyndet salpetersyre. Denne forbindelse er en ekstremt ustabil fri radikal, da den reagerer med Oto i luften for at danne NO-gasto.
Nitrit (NOto-) i basisk opløsning og salpetersyre (HNOto) i syreopløsning er eksempler på forbindelser med oxidationstilstand +3. Disse kan være oxidationsmidler til normalt at producere NO (g) eller reduktionsmidler til dannelse af nitrationen..
Dinitrogentrioxid (NtoELLER3) og nitrogruppen (R-NOto) er andre eksempler på nitrogenforbindelser med valens +3.
Salpetersyre (NOto) eller nitrogendioxid er en nitrogenforbindelse med valens +4. Det er en brun gas, der generelt produceres ved omsætning af koncentreret salpetersyre med mange metaller. Nedtones til dannelse af NtoELLER4.
I +5-tilstand finder vi nitrater og salpetersyre, som er oxidationsmidler i syreopløsninger. I dette tilfælde har nitrogen 2 elektroner i valensskallen, som er i 2S-orbitalen. (Oxidationstilstande for nitrogen, S.F.).
Der er også forbindelser såsom nitrosilazid og dinitrogentrioxid, hvor nitrogen har forskellige oxidationstilstande i molekylet. I tilfælde af nitrosilazid (N4O) nitrogen har en valens på -1, 0, + 1 og +2; og i tilfælde af dinitrogentrioxid har den valens +2 og +4.
Nomenklatur for nitrogenforbindelser
I betragtning af kompleksiteten i kemien af nitrogenforbindelser var den traditionelle nomenklatur ikke nok til at navngive dem, og desto mindre identificere dem korrekt. Det er blandt andet grunden til, at Den Internationale Union for ren og anvendt kemi (IUPAC) skabte en systematisk nomenklatur, hvor forbindelser er navngivet efter antallet af atomer, de indeholder..
Dette er gavnligt, når det gælder navngivning af nitrogenoxider. For eksempel kaldes nitrogenoxid nitrogenmonoxid og dinitrogenmonoxid (NO) dinitrogenoxid (NtoELLER).
Derudover udviklede den tyske kemiker Alfred Stock i 1919 en metode til navngivning af kemiske forbindelser baseret på oxidationstilstanden, som er skrevet med romertal mellem parenteser. Således kaldes nitrogenoxid og nitrogenoxid for eksempel henholdsvis nitrogenoxid (II) og nitrogenoxid (I) (IUPAC, 2005).
Referencer
- (2005). NOMENKLATUR AF UORGANISK KEMI IUPAC-anbefalinger 2005. Gendannet fra iupac.org.
- Oxidationstilstande for kvælstof. (S.F.). Gendannet fra kpu.ca.
- Reusch, W. (2013, 5. maj). Elektronkonfigurationer i det periodiske system. Gendannet fra chemistry.msu.edu.
- Reusch, W. (2015, 8. august). Oxidationstilstande for kvælstof. Gendannet fra chem.libretexts.org.
- Sanderson, R. T. (2016, 12. december). Element af kvælstofgruppe. Gendannet fra britannica.com.
- Tyagi, V. P. (2009). Essential Chemistry XII. Ny deli: Ratna Sagar.
- Valenselektroner. (S.F.). Gendannet fra chemistry.tutorvista.com.
- Wandell, A. (2016, 13. december). Kemisk kvælstof. Gendannet fra chem.libretexts.org.


Endnu ingen kommentarer