
Bariumoxid (BaO) struktur, egenskaber, anvendelser, risici

Det bariumoxid Det er et uorganisk fast stof dannet af et bariumatom (Ba) og et oxygenatom (O). Dens kemiske formel er BaO. Det er et hvidt krystallinsk fast stof og er hygroskopisk, dvs. det absorberer fugt fra luften, men når det gør det, reagerer det med det..
Den hurtige reaktion af bariumoxid med vand gør det brugt i kemiske analyselaboratorier til at tørre ud, dvs. fjerne vand fra organiske opløsningsmidler, som er flydende forbindelser, der tjener til at opløse andre stoffer..

BaO opfører sig som en stærk base, derfor reagerer den med mange typer syrer. Reagerer f.eks. Let med kuldioxid COto fra luften til dannelse af bariumcarbonat BaCO3.
Det bruges til fremstilling af polymerer til strømkabler og som en ingrediens til harpikser til tætning af huller i tænder, der er hærdet.
Bariumoxid (BaO) anvendes også i den keramiske industri, både til belægning med glasur og til fremstilling. Det bruges også i cementblandinger for at øge trykstyrken af slutproduktet..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 4 Kemiske egenskaber
- 5 risici
- 6 Opnåelse
- 7 anvendelser
- 7.1 Som tørremiddel til organiske opløsningsmidler
- 7.2 I afladningslamper
- 7.3 Ved fremstilling af keramik
- 7.4 Ved fremstilling af cementblandinger
- 7.5 I forskellige applikationer
- 8 Referencer
Struktur
Bariumoxid BaO består af en Ba-kationto+ og en iltanion Oto-.
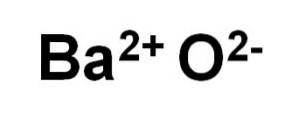
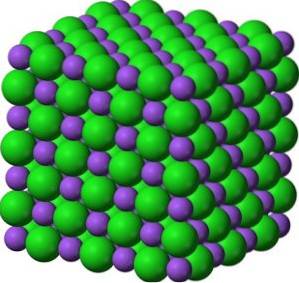
I sine krystaller danner BaO kubiske ioniske netværk (terningformet) af natriumchloridtypen.
Elektronkonfigurationen af bariumionen er: [Xe] 6s0 da det har mistet de to elektroner i 6s skal. Denne konfiguration er meget stabil.
Nomenklatur
-Bariumoxid
-Bariummonoxid
Fysiske egenskaber
Fysisk tilstand
Gulhvidt krystallinsk fast stof.
Molekylær vægt
153,33 g / mol
Smeltepunkt
1923 ºC
Kogepunkt
Ca. 2000 ºC.
Massefylde
5,72 g / cm3
Opløselighed
Let opløselig i vand: 3,8 g / 100 ml ved 20 ºC.
Kemiske egenskaber
Bariumoxid BaO reagerer hurtigt med vand, afgiver varme og danner en ætsende opløsning af bariumhydroxid Ba (OH)to, som er det mest opløselige hydroxid blandt jordalkalimetalhydroxiderne.
BaO + HtoO → Ba (OH)to
BaO er en stærk base. Reagerer eksotermt (dvs. med varmeudvikling) med alle typer syrer.
Med COto BaO reagerer til dannelse af bariumcarbonat BaCO3.
BaO + COto → BaCO3
BaO er hygroskopisk, så hvis det efterlades udsat for miljøet, slutter det sig lidt efter lidt med luftens fugtighed og danner Ba (OH)to som kombineres med kuldioxid COto fra luften for at give bariumcarbonat BaCO3.
Når bariummonoxid BaO opvarmes i nærvær af luft, kombineres det med ilt til dannelse af bariumperoxid BaOto. Reaktionen er reversibel.
2 BaO + Oto Ba 2 BaOto
I nærvær af vand kan det reagere med aluminium Al eller zink Zn, danne oxiderne eller hydroxiderne af metallerne og generere hydrogengas Hto.
Kan starte polymerisation af polymeriserbare organiske forbindelser, såsom epoxider.
Risici
Kan være giftigt ved indtagelse. Det bør ikke komme i kontakt med huden. Det irriterer øjnene, huden og luftvejene. Det kan være skadeligt for nervesystemet. Det er i stand til at forårsage lave kaliumniveauer, hvilket resulterer i hjerte- og muskelforstyrrelser.
Opnåelse
Bariumoxid BaO kan opnås ved opvarmning af bariumcarbonat BaCO3 med trækul. BaO dannes, og der frigøres kuliltegas CO.
Bacchus3 + C → BaO + 2 CO ↑
Ansøgninger
Som tørremiddel til organiske opløsningsmidler
På grund af sin lette reaktion med vand er BaO blevet brugt siden midten af forrige århundrede som et tørremiddel til benzin og basiske eller neutrale organiske opløsningsmidler..
BaO tørrer meget aktivt omkring det, det optager fugt meget hurtigt med udvikling af en hel del varme og danner bariumhydroxid Ba (OH)to som er stabil op til ca. 1000 ºC. Af denne grund kan BaO bruges ved høje temperaturer..
Det har også en høj vandabsorptionsevne. For hvert molekyle af BaO kan et af vandet og Ba (OH) absorberesto resulterende kan også absorbere en vis mængde vand.
Det er velegnet til analytiske kemilaboratorier. Ikke klæbrig.
Det kan bruges i ekssikkatorer, som er store glasbeholdere med låg, hvor det indre miljø holdes tørt. BaO holder ekssikkatorens miniaturatmosfære tør.

Disse ekssikkatorer bruges til at placere stoffer eller reagenser og forhindre dem i at absorbere vand fra miljøet.
Det bruges også til at tørre basiske gasser såsom NH-ammoniak.3.
I afladningslamper
BaO placeres på elektroderne i afladningslamper som et elektronemitterende materiale.
Udladningslamper er lavet af et rør af glas, kvarts eller andet egnet materiale, de indeholder en inert gas og i de fleste tilfælde en metaldamp. Metaldamp kan være natrium eller kviksølv.

Elektriske udladninger forekommer inde i røret, fordi det har en positiv og en negativ elektrode.
BaO'en er placeret på lampens elektroder. Elektronerne, som det udsender, kolliderer med atommerne i metalets damp og overfører energi til dem..
Når en elektrisk strøm passerer gennem denne gas eller damp, frembringes synligt lys eller ultraviolet (UV) stråling..
Til fremstilling af keramik
BaO anvendes i keramiske glasurbelægningssammensætninger.

Imidlertid er det også blevet testet som et additiv til fremstilling af glaskeramik.
BaO forbedrer effektivt de mekaniske egenskaber og kemiske modstandsdygtighed for denne type keramik. Det har en stærk indflydelse på de termiske egenskaber og sammensætningen af den krystallinske fase af de opnåede materialer..
Ved fremstilling af cementblandinger
BaO er testet som en komponent af phosphoaluminatcement.
Denne type cement er nyttig i havmiljøer, da den ikke har den samme tendens til at hydratisere som andre typer cement, så den lider ikke under poredannelse eller ekspansion..
Imidlertid skal phosphoaluminatcement styrkes i deres mekaniske ydeevne for at modstå havstrømme og slag fra flydende isstykker, der findes i havet..
Tilsætningen af BaO til phosphoaluminatcementen modificerer materialets mineralstruktur, forbedrer porestrukturen og øger cementpastaens trykstyrke betydeligt..
Med andre ord forbedrer BaO kompressionsstyrken for denne type cement..

I forskellige applikationer
Det bruges som en ingrediens til at tilvejebringe opacitet i tandharpikser til fyldning af huller i tænderne, udført af tandlæger.
Det bruges også som et kimdannende middel til fremstilling af polyvinylidenfluoridpolymerer, der bruges til at isolere strømkabler..
Referencer
- Partyka, J. et al. (2016). Effekt af tilsætning af BaO på sintring af glaskeramiske materialer fra SiOto-TiltoELLER3-NatoOKAYtoO-CaO / MgO-system. J Therm Anal Calorim (2016) 125: 1095. Gendannet fra link.springer.com.
- Zhang, P. et al. (2019). Effekt af BaO på mineralstruktur og hydratiseringsadfærd for phosphoaluminatcement. J Therm Anal Calorim (2019) 136: 2319. Gendannet fra link.springer.com.
- OS. National Library of Medicine. (2019). Bariumoxid. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Belysning. Princip. I Electrical Engineer's Reference Book (sekstende udgave). Gendannet fra sciencedirect.com.
- Ebnesajjad, S. (2003). Fluorpolymerskum. Skummende PVDF. I smeltbare processerbare fluorplaster. Gendannet fra sciencedirect.com.
- Booth, H.S. og McIntyre, L.H. (1930). Bariumoxid som et tørremiddel. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Gendannet fra pubs.acs.org.


Endnu ingen kommentarer