
Lithiumoxidformel, egenskaber, risici og anvendelser

Det lithiumoxid Det er en uorganisk kemisk forbindelse med formlen LitoEller der dannes sammen med små mængder lithiumperoxid, når lithiummetal brænder i luft og kombineres med ilt..
Indtil 1990'erne var metal- og lithiummarkedet domineret af amerikansk produktion fra mineralforekomster, men i begyndelsen af det 21. århundrede stammede mest produktion fra ikke-amerikanske kilder; Australien, Chile og Portugal var de vigtigste leverandører i verden. Bolivia har halvdelen af lithiumaflejringerne i verden, men det er ikke en stor producent.
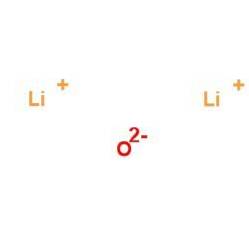
Den vigtigste kommercielle form er lithiumcarbonat, LitoCO3, fremstillet af mineraler eller saltlage ved flere forskellige processer.
Når lithium forbrændes i luft, er hovedproduktet det hvide oxid af lithiumoxid, LitoO. Derudover produceres noget lithiumperoxid, LitoELLERto, også hvid.
Det kan også ske gennem termisk nedbrydning af lithiumhydroxid, LiOH eller lithiumperoxid, Li2O2.
4Li (s) + Oto(g) → 2LitoDu)
2LiOH (s) + varme → LitoO (s) + HtoO (g)
2LitoELLERto(s) + varme → 2LitoO (s) + Oto(g)
Fysiske og kemiske egenskaber
Lithiumoxid er et hvidt fast stof kendt som lithia, der mangler aroma og har en salt smag. Dets udseende er vist i figur 2 (National Center for Biotechnology Information, 2017).

Figur 2: udseende af lithiumoxid
Lithiumoxid er krystaller med antifloritgeometri svarende til natriumchlorid (ansigtscentreret kubisk). Dens krystallinske struktur er vist i figur 3 (Mark Winter [University of Sheffield and WebElements Ltd, 2016).
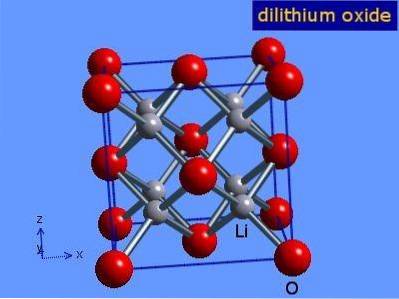
Figur 3: krystallinsk struktur af lithiumoxid.
Dens molekylvægt er 29,88 g / mol, dens densitet er 2,013 g / ml, og dens smelte- og kogepunkter er henholdsvis 1438 ° C og 2066 ° C. Forbindelsen er meget opløselig i vand, alkohol, ether, pyridin og nitrobenzen (Royal Society of Chemistry, 2015).
Lithiumoxid reagerer let med vanddamp til dannelse af hydroxid og med carbondioxid til dannelse af carbonat; derfor skal det opbevares og håndteres i en ren og tør atmosfære..
Oxidforbindelser leder ikke elektricitet. Imidlertid er visse strukturerede oxider af perovskit elektroniske ledere, der finder anvendelse i katoden af faste oxidbrændselsceller og iltgenereringssystemer..
De er forbindelser, der indeholder mindst en iltanion og en metalkation (American Elements, S.F.).
Reaktivitet og farer
Lithiumoxid er en stabil forbindelse, der er uforenelig med stærke syrer, vand og kuldioxid. Så vidt vi ved, er de kemiske, fysiske og toksikologiske egenskaber af lithiumoxid ikke grundigt undersøgt og rapporteret..
Toksiciteten af lithiumforbindelser er en funktion af deres opløselighed i vand. Lithiumionen har toksicitet i centralnervesystemet. Forbindelsen er stærkt ætsende og irriterende, hvis den kommer i kontakt med øjne, hud, ved indånding eller indtagelse (ESPI METALS, 1993).
I tilfælde af kontakt med øjnene skal du kontrollere, om du har kontaktlinser, og fjerne dem med det samme. Øjne skal skylles med rindende vand i mindst 15 minutter, så øjenlågene holdes åbne. Koldt vand kan bruges. Øjen salve bør ikke bruges.
Hvis kemikaliet kommer i kontakt med tøj, skal du fjerne det så hurtigt som muligt og beskytte dine egne hænder og krop. Anbring offeret under et sikkerhedsbrusebad.
Hvis kemikaliet akkumuleres på offerets udsatte hud, såsom hænder, vaskes den forurenede hud forsigtigt og omhyggeligt med rindende vand og ikke-slibende sæbe. Koldt vand kan bruges. Søg lægehjælp, hvis irritationen vedvarer. Vask det forurenede tøj, inden det bruges igen.
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område. Hvis inhalationen er svær, skal offeret evakueres til et sikkert område hurtigst muligt..
Løsn stramt tøj såsom en skjortekrave, bælte eller slips. Hvis offeret har svært ved at trække vejret, skal der gives ilt. Hvis offeret ikke trækker vejret, udføres genoplivning fra mund til mund.
Husk altid, at det kan være farligt for den person, der yder hjælp til at give genoplivning fra mund til mund, når det indåndede materiale er giftigt, smitsomt eller ætsende..
I alle tilfælde bør øjeblikkelig lægehjælp søges (SIGMA-ALDRICH, 2010).
Ansøgninger
Lithiumoxid bruges som flux i keramiske glasurer og skaber blues med kobber og lyserøde med kobolt. Lithiumoxid reagerer med vand og damp til dannelse af lithiumhydroxid og skal isoleres fra dem.
Lithiumoxid (LitoO) med sit høje tritiumpotentiale er en attraktiv kandidat til det faste kulturmateriale i et DT-fusionskraftværk på grund af dets høje tæthed af lithiumatomer (sammenlignet med andre lithium- eller lithiummetalkeramikker) og dets ledningsevne relativt høj termisk (LITIUMOXID (Li2O), SF).
LitoEller det vil blive udsat for høje temperaturer under neutronbestråling under smeltende tæppedrift. Under disse omstændigheder vil der forekomme et stort antal bestrålingsfejl i LitoEller såsom heliuminduceret hævelse, relativt høj termisk ekspansion, kornvækst, dannelse af LiOH (T) og nedbør ved lave temperaturer og LiOH (T) massetransport ved høje temperaturer.
Desuden har LitoEller det vil blive udsat for spændinger som følge af forskelle i termisk ekspansion mellem LitoEller og strukturelle materialer. Disse egenskaber ved LitoEller føre til udfordrende tekniske problemer inden for både tæppeproduktion og design.
En mulig ny anvendelse er som erstatning for lithiumcobaltoxid som katoden i lithium-ion-batterier, der bruges til at drive elektroniske enheder fra mobiltelefoner til bærbare computere samt batteridrevne biler (Reade International Corp, 2016)..
Referencer
- Mark Winter [University of Sheffield and WebElements Ltd. (2016). webelementer. Hentet fra lithium: dilithiumoxid webelements.com.
- Amerikanske elementer. (S.F.). Lithiumoxid. Hentet fra americanelements americanelements.com.
- ESPI METALER. (1993, juni). Lithiumoxid. Hentet fra espimetals espimetals.com.
- LITIUMOXID (Li2O). (S.F.). Hentet fra ferp.ucsd.edu ferp.ucsd.edu.
- National Center for Biotechnology Information. (2017, 24. juni). PubChem Compound Database; CID = 166630. Hentet fra PubChem pubchem.ncbi.nlm.nih.gov.
- Reade International Corp. (2016). Lithiumoxidpulver (Li2O). Hentet fra reade reade.com
- Royal Society of Chemistry. (2015). Lithiumoxid.Hentet fra chemspiderchemspider.com.
- SIGMA-ALDRICH. (2010). Sikkerhedsdatablad Lithiumoxid. Hentet fra chemblink chemblink.com.

Endnu ingen kommentarer