
Acetonitril (C2H3N) Struktur, egenskaber, anvendelser
Det acetonitril Det er et stof af organisk oprindelse, der kun består af kulstof, brint og nitrogen. Denne kemiske art tilhører gruppen af nitriler, hvor acetonitril er den med den enkleste struktur blandt de af den organiske type..
Nitriler er en klasse af kemiske forbindelser, hvis struktur består af en cyanidgruppe (CN-) og en radikal kæde (-R). Disse elementer er repræsenteret af følgende generelle formel: R-C3N.
Det er kendt, at dette stof primært stammer fra produktionen af en anden art kaldet acrylonitril (en anden simpel nitril med molekylær formel C3H3N, som anvendes til fremstilling af produkter i tekstilindustrien) som et biprodukt af samme.
Derudover betragtes acetonitril som et opløsningsmiddel med egenskaber med medium polaritet, hvorfor det bruges ret regelmæssigt i RP-HPLC (reverse phase high performance liquid chromatography) analyser..
Artikelindeks
- 1 Struktur
- 2 egenskaber
- 3 anvendelser
- 4 risici
- 5 Referencer
Struktur
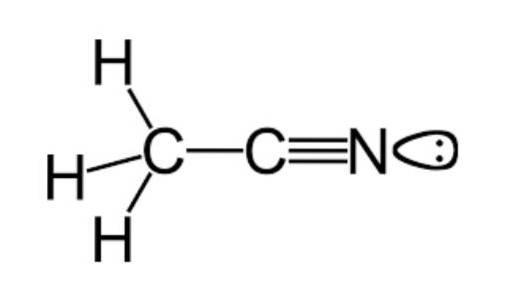
Som tidligere nævnt tilhører acetonitril den funktionelle gruppe af nitriler med en molekylformel, der almindeligvis er repræsenteret som CtoH3N, som kan ses i strukturformlen, der er eksemplificeret i den øverste figur.
Dette billede viser en slags lap, der er fastgjort til nitrogenatomet, hvilket repræsenterer det par uparrede elektroner, som dette atom har, og som giver det en stor del af de reaktivitets- og stabilitetsegenskaber, der er karakteristiske for det..
På denne måde viser denne art en meget særlig opførsel på grund af dens strukturelle arrangement, som oversættes til svaghed for at modtage hydrogenbindinger og ringe evne til at donere elektroner..
Dette stof opstod også for første gang i anden halvdel af 1840'erne og blev fremstillet af videnskabsmanden ved navn Jean-Baptiste Dumas, hvis nationalitet var fransk.
Den strukturelle konformation af dette stof gør det muligt at have karakteristika for sit eget opløsningsmiddel af organisk karakter..
Til gengæld tillader denne egenskab acetonitril at blive blandet med vand samt en række andre opløsningsmidler af organisk oprindelse med undtagelse af carbonhydrider eller mættede carbonhydridarter..
Ejendomme
Denne forbindelse har en række egenskaber, der adskiller den fra andre af samme klasse, som er angivet nedenfor:
- Det er i flydende tilstand af aggregering under standardbetingelser for tryk og temperatur (1 atm og 25 ° C).
- Dens molekylære konfiguration giver den en molær masse eller molekylvægt på ca. 41 g / mol.
- Det betragtes som nitril, der har den enkleste struktur blandt den organiske type.
- Dens optiske egenskaber gør det muligt at være farveløs i denne flydende fase og med fugtige egenskaber ud over at have en aromatisk lugt..
- Den har et flammepunkt på omkring 2 ° C, hvilket svarer til 355 ° F eller 275,1 K.
- Det har et kogepunkt i området 81,3 til 82,1 ° C, en densitet på ca. 0,786 g / cm3 og et smeltepunkt, der er mellem -46 og -44 ° C.
- Det er mindre tæt end vand, men blandbart med det og med en række organiske opløsningsmidler.
- Det udviser en dielektrisk konstant på 38,8 ud over et dipolmoment på ca. 3,92 D.
- Det er i stand til at opløse en lang række stoffer med ionisk oprindelse og ikke-polær natur.
- Det bruges i vid udstrækning som en mobil fase i HPLC-analyse, som har høje antændelsesegenskaber.
Ansøgninger
Blandt det store antal applikationer, som acetonitril har, kan følgende tælles:
- Tilsvarende kan andre arter af nitriler gennemgå en metaboliseringsproces i mikrosomer (vesikulære elementer, der er en del af leveren), især i dette organ, for at producere hydrocyansyre..
- Det bruges i vid udstrækning som en mobil fase i den type analyse, der kaldes revers fase højtydende væskekromatografi (RP-HPLC); som et eluerende stof, der har høj stabilitet, stor elueringsevne og lav viskositet.
- I tilfælde af anvendelser af industriel størrelse anvendes denne kemiske forbindelse i råolieraffinaderier som opløsningsmiddel i visse processer, såsom oprensning af alkenen kaldet butadien..
- Det bruges også som en ligand (kemisk art, der kombineres med et atom af et metalelement, der betragtes som centralt i det givne molekyle for at danne en forbindelse eller et koordinationskompleks) i et stort antal nitrilforbindelser med metaller fra overgangsgruppen.
- Tilsvarende anvendes det i organisk syntese til et stort antal sådanne fordelagtige kemikalier som a-naphthaleneddikesyre, thiamin eller acetamidinhydrochlorid..
Risici
Risiciene forbundet med eksponering for acetonitril er forskellige. Blandt disse er en nedsat toksicitet, når eksponeringen er i en reduceret tidsperiode og i lave mængder, der metaboliseres til produktion af hydrocyansyre..
Ligeledes har der sjældent været registrerede tilfælde af mennesker, der er blevet forgiftet med denne kemiske art, blevet forgiftet af cyanidet, der er til stede i molekylet efter at have været i kontakt med acetonitril i forskellige grader (ved indånding, indtagelse eller absorbering gennem huden).
Af denne grund er konsekvenserne af dets toksicitet forsinket, fordi kroppen ikke let metaboliserer dette stof i cyanid, da det tager to til tolv timer, før dette sker..
Imidlertid absorberes acetonitril let fra lungerne og mave-tarmkanalen. Derefter sker dets fordeling i hele kroppen, sker hos mennesker og endda hos dyr og når nyrerne og milten..
På den anden side er acetonitril ud over de brændbarhedsrisici, det er en forløber for stoffer, der er så giftige som hydrocyansyre eller formaldehyd. Dens anvendelse i produkter, der tilhører det kosmetiske område, var endda forbudt i det såkaldte Europæiske Økonomiske Samarbejdsområde i 2000..
Referencer
- Wikipedia. (s.f.). Acetonitril. Hentet fra en.wikipedia.org
- PubChem. (s.f.). Acetonitril. Gendannet fra pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Fremskridt inden for kromatografi. Hentet fra books.google.co.ve
- ScienceDirect. (s.f.). Acetonitril. Hentet fra sciencedirect.com
- ChemSpider. (s.f.). Acetonitril. Hentet fra chemspider.com



Endnu ingen kommentarer