
EMB-agarfundament, forberedelse og anvendelse
Det EMB agar er et selektivt og differentieret fast dyrkningsmedium, der anvendes til isolering af Gram-negative baciller, hovedsageligt af Enterobacteriaceae-familien, og andre ikke-kræsne Gram-negative baciller. Det er også kendt under akronymet EAM, som står for eosin-methylenblåt..
Dette medium blev skabt af Holt-Harris og Teague i 1916. Det indeholder pepton, lactose, saccharose, dikaliumphosphat, agar, eosin, methylenblåt og vand. Det ligner meget MacConkey Agar, især når du bruger Levines modificerede EMB-agar, som ikke indeholder saccharose.
Faktisk beslutter hvert laboratorium, om de skal arbejde med den ene eller den anden, da de udfører den samme funktion, selvom de er biokemisk forskellige..
Det har endda den samme ulempe som klassisk MacConkey-agar med hensyn til sværmende produktion af slægten Proteus. Derfor kan agarkoncentrationen øges med op til 5% for at undgå dette fænomen..
Artikelindeks
- 1 begrundelse
- 1.1 Selektiv
- 1.2 Differentiale
- 2 Forberedelse
- 3 anvendelser
- 4 Kvalitetskontrol
- 5 Afsluttende overvejelser
- 6 Referencer
Basis
Selektiv
EMB-agar er subtilt selektiv, fordi den indeholder anilinfarvestoffer (eosin og methylenblåt), der fungerer som hæmmere, hvilket forhindrer væksten af de fleste Gram-positive bakterier og nogle kræsne Gram-negative stænger..
Denne agar har imidlertid den ulempe, at nogle Gram-positive bakterier kan modstå tilstedeværelsen af hæmmende stoffer og vokse som små farveløse nøjagtige kolonier, såsom Enterococcus faecalis og nogle Staphylococcus.
Visse gær kan også vokse, såsom Candida albicans-kompleks, som giver meget små lyserøde kolonier. Chlamydosporer kan endda udvikle sig fra denne gær, hvis prøven er dybsået..
Differentiale
På den anden side er EMB-agar også et differentieret medium, da disse farvestoffer sammen (eosin og methylenblåt) har den egenskab, at de danner et bundfald ved sur pH, hvorfor de tjener som indikatorer for dets produktion..
Således producerer svagt lactose- eller saccharosefermenterende bakterier lilla kolonier inden for 24 til 48 timer. For eksempel slægterne Klebsiella, Enterobacter og Serratia.
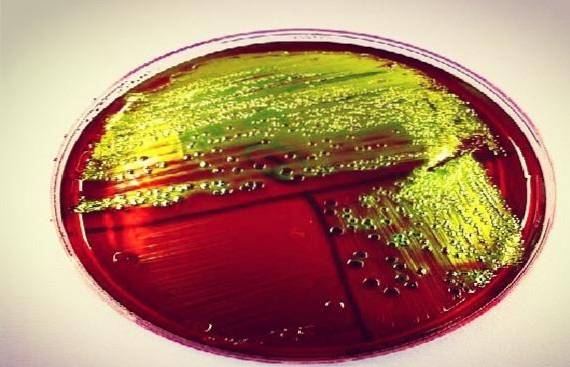
De bakterier, der stærkt gærer lactose, såsom Escherichia coli, eller saccharose, ligesom Yersinia enterocolitica eller Proteus penneri, danner et grønsvart bundfald, der giver et karakteristisk metallisk glansudseende hos disse arter.
Det skal bemærkes, at hvis der anvendes EMB-levinemedium (uden saccharose), Yersinia enterocolitica Y Proteus penneri vil producere klare kolonier.
Bakterier, der ikke gærer lactose eller saccharose, næres af tilstedeværelsen af peptoner, som tilvejebringer de aminosyrer og nitrogen, der er nødvendige for bakterievækst, og producerer klare kolonier. For eksempel slægterne Salmonella og Shigella, blandt andre.
Ligeledes er det vigtigt at bemærke, at Acinetobacter-slægten kan præsentere lavendelblå kolonier, selvom det ikke er en lactosefermenter eller saccharose, men har den egenskab at fiksere methylenblåt på dets cellevæg. Dette kan også ske med andre oxidative bakterier.
Forberedelse
Det originale dehydratiserede medium har en lys beige farve.
For at fremstille dette dyrkningsmedium skal 36 g af det dehydratiserede medium vejes og suspenderes i en kolbe, der indeholder en liter destilleret vand..
Efter at have ladet blandingen hvile i 5 minutter, skal du tage kolben til en varmekilde, blande kraftigt og konstant, indtil den koger og opløses helt..
Derefter skal det allerede opløste dyrkningsmedium steriliseres ved hjælp af autoklaven ved 121 ° C i 15 minutter..
I slutningen af tiden fjernes den fra autoklaven og lades hvile kort. Derefter serveres der stadig varm (45-50 ° C) 15-20 ml agar i hver steril petriskål. Mediet skal være lakmusblåt.
Efter servering efterlades pladerne let afdækkede, indtil agaren afkøles let. De dækkes derefter og får lov til at størkne fuldstændigt. Derefter bestilles de i omvendte pladeholdere og opbevares i køleskab (8 ° C) indtil brug..
Denne procedure udføres fortrinsvis i en laminær strømningshætte eller foran Bunsen-brænderen for at undgå forurening.
Det er vigtigt at huske på, at hvert kommercielt hus angiver den mængde, der skal vejes for at forberede dyrkningsmediet..
Mediets endelige pH skal være 7,2 ± 0,2
Ansøgninger
Dette medium bruges til at så urin og afføring eller enhver form for klinisk prøve, især hvis der er mistanke om tilstedeværelsen af ikke-krævende gramnegative baciller, såsom de baciller, der tilhører Enterobacteriaceae-familien, som vokser meget godt på dette medium..
Enteropatogene bakterier af slægterne Shigella og Salmonella er kendetegnet ved deres farveløse eller let gule kolonier.
Andre ikke-lactose-fermenterende baciller vokser også, såsom blandt andet Aeromonas, Pseudomonas, Acinetobacter..
Ligeledes er dette medium meget nyttigt i den mikrobiologiske analyse af mad og vand, da det er ideelt til den komplette bekræftende fase af bestemmelsen af coliforme stoffer, det vil sige at bekræfte tilstedeværelsen af E coli fra uklare EF-bouillon, fra den mest sandsynlige talteknik (MPN).
QA
For at kontrollere, at det frisklavede dyrkningsmedium fungerer godt, kan der plantes kontrolstammer for at observere koloniernes egenskaber og kontrollere, at de giver som forventet..
Til dette ATCC stammer eller velidentificerede stammer af E coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa og nogle Gram-positive bakterier, såsom S. aureus.
Det forventes, at E coli Generer veludviklede blåsorte kolonier med grøn metallisk glans. Mens, Enterobacter aerogenes Y Klebsiella sp de skal give veludviklede blå-sorte slimhindekolonier.
For hans del, Salmonella typhimurium Y Shigella flexneri, skal udvikle store, farveløse eller let gule kolonier.
Endelig genren Pseudomonas aeruginosa vokser som farveløse kolonier af uregelmæssig størrelse, mens grampositive bakterier skal hæmmes fuldstændigt eller vokse tyndt med meget små kolonier.
Afsluttende tanker
Undertiden får sterilisering methylenblåt til at blive reduceret og viser en medium orange farve. For at methylenblåt oxiderer og genvinder den lilla farve, skal den blandes forsigtigt, indtil farven er genvundet..
Efter sterilisering kan farvestoffet også udfældes, så det skal blandes godt inden servering af petriskålene..
Referencer
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B og Velázquez O. 2009. Teknikker til mikrobiologisk analyse af fødevarer. 2. udgave Det kemiske fakultet, UNAM. Mexico.
- Carranza C, León R, Falcón N, Neumann A, Kromm C. Karakterisering og distribution af stammer af Escherichia coli Potentielt patogen isoleret fra slagtekyllinger fra fjerkræbedrifter i Peru. Præst investiga. dyrlæge. Peru 2012 23 (2): 209-219. Tilgængelig på: scielo.org.
- Laboratorios Conda S.A. Eosin og methylenblå agar. 2010.Tilgængelig på: condalab.com
- Britannia Laboratories. Levine EMB (With Eosin and Methylene Blue) 2011.Tilgængelig på: britanialab.com
- BD Laboratories. BD EMB Agar (Eosin Methylen Blue Agar), modificeret. 2013. Tilgængelig på: bd.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. udgave). Argentina, redaktionelt Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiologisk diagnose. 12. udgave Argentina. Redaktionel Panamericana S.A



Endnu ingen kommentarer