
Aniondannelse, egenskaber og typer
EN anion Det er enhver kemisk art med en negativ ladning ud over at være en af de to typer af eksisterende ioner. Dens negative ladning stammer fra det faktum, at den har et overskud af elektroner i forhold til artenes neutrale form; for hver yderligere elektron stiger dens negative ladning med en enhed.
Den negative ladning kan være placeret i et eller flere atomer såvel som at omfatte dens indflydelse på et molekyle som helhed. For enkelheds skyld betragtes hele arten, forbindelsen eller molekylet som en anion uanset hvor ladningen er (-)..
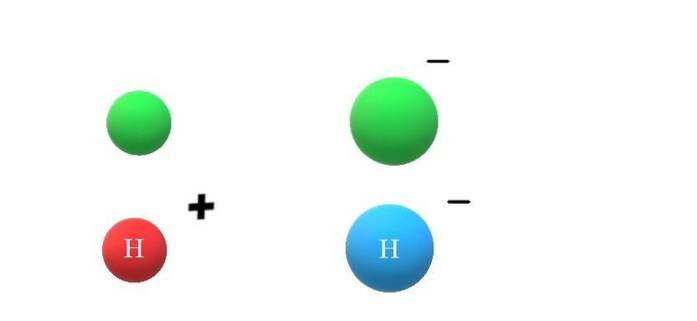
Hvis en neutral art X får en elektron, vil de overskydende negative ladninger manifestere sig i dannelsen af anionen X-, hvilket også vil føre til en stigning i dets atomare radius (øverste billede med grønne kugler). X og X- adskiller sig enormt i deres egenskaber og i den måde, de interagerer med deres miljø på.
Hvis X for eksempel antages at være H-atom, kan der opstå en kation eller anion fra det: H+ eller H-, henholdsvis. Kationen H+ Det er hydrogenionen, også kaldet en proton; og H- er hydridanionen, den "enkleste" af alle kendte anioner.
Artikelindeks
- 1 Dannelse af en anion
- 1.1 Formelle afgifter og færre links
- 1.2 Reduktioner
- 1.3 Fysik
- 2 funktioner
- 3 typer
- 3.1 Monatomisk
- 3.2 Oxoanioner
- 3.3 Organisk
- 3.4 Polyatomisk
- 3.5 Molekylær eller kompleks
- 4 Referencer
Dannelse af en anion
Dannelsen af en anion kan let forklares inden for teorien; Selvom det eksperimentelt kan være en udfordring, især hvis du vil have det rent, uden positive ladninger tiltrukket af dets negative ladninger..
Formelle afgifter og færre links
En anion vil dannes, når der er et overskud eller gevinst af elektroner i et atom. Den nævnte gevinst kan bestemmes ved at anvende de formelle afgifter i en Lewis-struktur. Ved hjælp af den foregående metode kan du også vide nøjagtigt fra hvilket atom eller gruppe af dem den negative ladning kommer.
Når atomer danner kovalente bindinger, selvom fordelingen af elektroner er retfærdig, kan der være et delvis tab af elektroner. I denne forstand, jo færre bindinger jo flere elektronegative atomer dannes, jo flere frie elektronpar har de og udviser derfor negative ladninger..
Overvej for eksempel ammoniakmolekylet, NH3. NH3 den er neutral og har derfor ingen elektriske ladninger. Hvis en H blev fjernet, dvs. en N-H-binding blev brudt, ville anionen NH blive opnåetto-. Tegning af sin Lewis-struktur og beregning af den formelle ladning af N, kan dette verificeres.
Efter brud på flere NH-obligationer har vi nu NH-anionento-; og eliminering af det sidste H opnås endelig anionen N3-, kaldet nitridanion. Kvælstof har ikke længere en måde at få flere elektroner på, og dens -3 ladning er den mest negative, den kan nå; deres orbitaler giver ikke mere.
Reduktioner
En anion kan dannes som et resultat af en reduktion: den får elektroner ved at oxidere en anden art, der mister dem. Ilt repræsenterer for eksempel denne type kemisk reaktion meget godt..
Når ilt reduceres, oxideres det til en anden art og bliver oxidanionen Oto-; findes i utallige mineraler og uorganiske forbindelser.
Fysisk
Et atom kan få elektroner, hvis det er i gasfasen:
X (g) + e- => X-(g)
Denne måde at danne en anion på indebærer en bred viden om fysiske teknikker, mens gasformige anioner ikke er lette at studere, og heller ikke alle arter let fordampes eller forstøves til luftformen..
Egenskaber
Generelt vil de typiske egenskaber ved en anion blive nævnt nedenfor, før de diskuterer deres typer og eksempler:
-Det er større end det neutrale atom, hvorfra det stammer.
-Det kan være mere eller mindre stabilt på trods af den stigende elektroniske frastødning mellem dets egne elektroner.
-Hvis anionen kommer fra et lavelektronegativt atom, såsom kulstof, er det meget reaktivt.
-Etabler stærke dipolmomenter.
-Yderligere øger dets interaktion med polære opløsningsmidler.
-Den monatomiske anion er isoelektronisk over for ædelgassen i sin periode; det vil sige, det har det samme antal elektroner i sin valensskal.
-Det kan polarisere elektronskyen i et nærliggende atom og frastøde dets ydre elektroner.
Typer
Monatomisk
Som navnet antyder, er det en anion, der består af et enkelt atom: den negative ladning er godt placeret. Hver gruppe i det periodiske system har karakteristiske negative ladninger; og fordi de er anioner, er de ikke-metaller placeret i p-blokken. Nogle eksempler og deres navne er nedenfor:
-Cl-, klorid.
-jeg-, Jeg sidst.
-F-, fluor.
-Br-, bromid.
-ELLERto-, oxid.
-Sto-, sulfid.
-Jeg vedto-, selenid.
-Teto-, telluride.
-Poto-, poloniur.
-N3-, nitrid.
-P3-, phosphid.
-Es3-, arsenid.
-Sb3-, antimoniuro.
-C4-, hårdmetal.
-Ja4-, silicid.
-B3-, boruro.
Oxoanioner
Oxoanioner er kendetegnet ved at have en X = O-binding, hvor X kan være et hvilket som helst ikke-metallisk element (undtagen fluor) eller et metal (chrom, mangan, ect.). De kan også have en eller flere X-O enkle links.
Nogle oxoanioner med deres respektive navne er:
-ClO-, hypochlorit.
-Brormand-, hypobromit.
-IO-, hypoiodit.
-ClOto-, chlorit.
-ClO3-, klorat.
-IO3-, iodat.
-ClO4-, perchlorat.
-PO43-, fosfat.
-CO3to-, carbonat.
-CrO4to-, kromat.
-CrtoELLER7to-, dikromat.
-SW4to-, sulfat.
-StoELLER3to-, thiosulfat.
-IKKE3-, nitrat.
-IKKEto-, nitrit.
-BO33-, borat.
-AsO43-, arsenat.
-PO33-, phosphit.
-MnO4-, permanganat.
Økologisk
Organiske molekyler har funktionelle grupper, der kan blive elektrisk ladede. Hvordan? Gennem dannelse eller brud af kovalente bindinger, meget lig eksemplet med NH-molekylet3.
Nogle organiske anioner er:
-CH3COO-, acetat.
-HCOO-, Format.
-CtoELLER4to-, oxalat.
-RCOO-, carboxylat.
-CH3CONH-, amidate.
-RO-, alkoxid.
-R3C-, carbanion.
-CH3ELLER-, methoxid.
Polyatomisk
Oxoanioner er også polyatomiske anioner, dvs. de består af mere end et atom. Det samme sker med organiske anioner. Imidlertid falder polyatomika ikke ind under nogen af ovenstående klassifikationer. Nogle af dem er:
-CN-, cyanid (har en tredobbelt binding, C≡N).
-OCN-, cyanat.
-SCN-, thiocyanat.
-NHto-, Amide.
-Åh-, hydroxyl, hydroxid eller hydroxyl.
-ELLERto-, superoxid.
-ELLERtoto-, peroxid.
Molekylær eller kompleks
I organiske anioner blev nogle negativt ladede funktionelle grupper nævnt. Disse grupper kan være en del af et stort molekyle, og således kan anionen være en hel robust forbindelse med mange bindinger. Den enkleste af denne type anioner er det hypotetiske molekyle af H.to-.
Et andet eksempel på disse anioner er polysulfider, Snto-, som består af kæder med flere SS-obligationer. Også negativt ladede metalkoordineringsforbindelser, såsom [CoCl4(NH3)to]- og [CuCl4]to-.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2019). Anion. Gendannet fra: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (21. marts 2019). Fælles anioner tabel og formel liste. Gendannet fra: thoughtco.com
- CK-12 Foundation. (2016, 29. juni). Aniondannelse. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Francis E. (2002). Anioner. Clackamas Community College. Gendannet fra: dl.clackamas.edu
- American Physical Society. (3. november 2011). Synopsis: The Simplest Molecular Anion. Gendannet fra: physics.aps.org



Endnu ingen kommentarer