
Hydrogenbromid (HBr) egenskaber, syntese og anvendelser

Det hydrogenbromid, en kemisk forbindelse med formlen HBr, er det et diatomisk molekyle med en kovalent binding. Forbindelsen er klassificeret som et hydrogenhalogenid, idet det er en farveløs gas, der, når den opløses i vand, danner brombrintesyre og mætter sig ved 68,85% vægt / vægt ved stuetemperatur..
Vandige opløsninger ved 47,6% vægt / vægt danner en konstant kogende azeotrop blanding, der koger ved 124,3 ° C. Mindre koncentrerede, kogende opløsninger frigiver H2O, indtil sammensætningen af den konstantkogende azeotropiske blanding er nået..
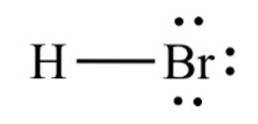
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 3 Håndtering og opbevaring
- 4 Syntese
- 5 anvendelser
- 6 Referencer
Fysiske og kemiske egenskaber
Hydrogenbromid er en farveløs gas ved stuetemperatur med en sur, irriterende lugt. Forbindelsen er stabil, men mørkner gradvist, når den udsættes for luft eller lys som illustreret i figur 2 (National Center for Biotechnology Information, S.F.).

Den har en molekylvægt på 80,91 g / mol og en densitet på 3,307 g / L, hvilket gør den tungere end luft. Gassen kondenserer og producerer en farveløs væske med et kogepunkt på -66,73 grader Celsius.
Efter fortsat afkøling størkner væsken, hvilket giver hvide krystaller, hvis smeltepunkt er -86,82 grader Celsius med en densitet på 2,603 g / ml (Egon Wiberg, 2001). Udseendet af disse krystaller er illustreret i figur 3.

Bindingsafstanden mellem brom og brint er 1,414 Ångstrøm, og deres dissociationsenergi er 362,5 kJ / mol..
Hydrogenbromid er mere opløseligt i vand end hydrogenchlorid. 221 g kan opløses i 100 ml vand ved 0 grader Celsius, hvilket svarer til et volumen på 612 liter af denne gas for hver liter vand. Det er også opløseligt i alkohol og andre organiske opløsningsmidler.
I vandig opløsning (hydrobromsyre) er de sure egenskaber ved HBr dominerende (som det er tilfældet med HF og HCI), og i bindingen mellem hydrogen og halogen er den svagere i tilfælde af hydrogenbromid end i hydrogenchlorid.
Derfor, hvis klor ledes gennem hydrogenbromidet, observeres dannelsen af brune dampe, der er karakteristiske for molekylært brom. Den reaktion, der forklarer det, er følgende:
2HBr + Cl2 → 2HCl + Br2
Dette er tegn på, at hydrogenbromid er et stærkere reduktionsmiddel end hydrogenchlorid, og at hydrogenchlorid er et bedre oxidationsmiddel..
Hydrogenbromid er en vandfri stærk syre (uden vand). Reagerer hurtigt og eksotermt med baser af alle slags (inklusive aminer og amider).
Reagerer eksotermt med carbonater (inklusive kalksten og kalkstenholdige byggematerialer) og hydrogencarbonater til dannelse af kuldioxid.
Reagerer med sulfider, carbider, borider og phosphider for at frembringe giftige eller brandfarlige gasser.
Reagerer med mange metaller (inklusive aluminium, zink, calcium, magnesium, jern, tin og alle alkalimetaller) for at generere brandfarlig brintgas.
Svar voldsomt med:
- eddikesyreanhydrid
- 2-aminoethanol
- ammoniumhydroxid
- calciumphosphid
- chlorsulfonsyre
- 1,1-difluorethylen
- ethylendiamin
- ethylenimin
- rygende svovlsyre
- perchlorsyre
- b-propriolacton
- propylens OXID
- sølvperchlorat
- Uran (IV) phosphid
- vinylacetat
- calciumcarbid
- rubidiumcarbid
- cæsiumacetylid
- rubidiumacetylid
- magnesiumborid
- kviksølv (II) sulfat
- calciumphosphid
- calciumcarbid (kemisk datablad, 2016).
Reaktivitet og farer
Brintbromid er klassificeret som en ætsende og irriterende forbindelse. Det er yderst farligt i tilfælde af kontakt med huden (irriterende og ætsende) og øjnene (irriterende) og i tilfælde af indtagelse og indånding (lungeirriterende).
Forbindelsen opbevares i beholdere med flydende gas under tryk. Langvarig udsættelse for ild eller intens varme kan resultere i en voldsom brud i beholderen under tryk, som kan frigøres og frigive irriterende giftige dampe..
Langvarig eksponering for lave koncentrationer eller kortvarig eksponering for høje koncentrationer kan medføre skadelige helbredseffekter på grund af indånding..
Termisk nedbrydning af vandfrit hydrogenbromid frembringer giftige bromgasser. Det kan blive brandfarligt, hvis det reagerer ved at frigive brint. Kontakt med cyanid producerer giftige hydrogencyanidgasser.
Indånding forårsager alvorlig irritation af næsen og øvre luftveje, som kan forårsage lungeskade..
Indtagelse medfører forbrændinger i mund og mave. Kontakt med øjnene forårsager alvorlig irritation og forbrændinger. Kontakt med huden forårsager irritation og forbrændinger.
Hvis dette kemikalie i opløsning kommer i kontakt med øjnene, skal de skylles straks med store mængder vand og lejlighedsvis løfte det nedre og det øvre øjenlåg..
Kontaktlinser bør ikke bæres, når du arbejder med dette kemikalie. Hvis øjenvæv er frossent, skal du straks søge lægehjælp..
Hvis vævet ikke er frosset, skal du straks skylle øjnene grundigt med store mængder vand i mindst 15 minutter, mens du undertiden løfter de nedre og øvre øjenlåg..
Hvis irritation, smerte, hævelse eller rive vedvarer, skal du søge lægehjælp hurtigst muligt..
Hvis dette kemikalie i opløsning kommer i kontakt med huden og ikke forårsager forfrysninger, skylles straks forurenet hud med vand.
Hvis dette kemikalie kommer på tøjet, skal du straks fjerne tøjet og vaske huden med vand.
Hvis der opstår forfrysninger, skal du straks søge lægehjælp. Du bør ikke gnide de berørte områder eller skylle med vand. For at forhindre yderligere beskadigelse af stoffer bør der ikke gøres forsøg på at fjerne frosne tøj fra frostige områder..
Hvis store mængder af dette kemikalie inhaleres, skal den udsatte person straks flyttes ud i frisk luft. Hvis vejrtrækningen er stoppet, skal du udføre genoplivning fra mund til mund. Offeret skal holdes varmt og i ro, og lægehjælp skal søges hurtigst muligt..
Hvis dette kemikalie i opløsning er blevet slugt, skal du straks søge lægehjælp.
Håndtering og opbevaring
Hydrogenbromidflasker skal opbevares på et køligt, godt ventileret sted. Dens håndtering skal ske med tilstrækkelig ventilation. Den skal kun opbevares, når temperaturen ikke overstiger 52 grader Celsius.
Beholdere skal være fastgjort i opretstående position for at forhindre dem i at falde eller blive ramt. Installer også ventilbeskyttelseshætten, hvis den findes, på plads med hånden, samt opbevar fyldte og tomme beholdere separat (praxair inkl., 2016).
Ved håndtering af produktet under tryk skal korrekt designet VVS-udstyr anvendes til at modstå det stødte tryk. Arbejd aldrig på et tryk under tryk, og brug en backflow-forebyggelsesenhed i rørledningen. Gasser kan forårsage hurtig kvælning på grund af iltmangel.
Opbevaring og anvendelse med tilstrækkelig ventilation er vigtig. Hvis der opstår lækage, skal du lukke beholderventilen og lukke systemet på en sikker og miljømæssig forsvarlig måde. Reparer derefter lækagen. Anbring aldrig en container, hvor den kan være en del af et elektrisk kredsløb.
Læderbeskyttelseshandsker og egnede sko skal bæres ved håndtering af cylindre. Disse skal beskyttes og til dette formål skal de undgås, trækkes, rulles eller glides..
Når cylinderen flyttes, skal det aftagelige ventilafdækning altid holdes på plads. Forsøg aldrig at løfte en cylinder ved dækslet, som udelukkende er beregnet til at beskytte ventilen..
Når du flytter cylindre, også over korte afstande, skal du bruge en vogn (vogn, håndtruck osv.) Designet til at transportere cylindre.
En genstand (f.eks. Skruenøgle, skruetrækker, lirkebjælke) må aldrig føres ind i åbningerne i dækslet, da det kan beskadige ventilen og forårsage lækage..
En justerbar remnøgle bruges til at fjerne hætter, der er for stramme eller rustne. Ventilen skal åbne langsomt, og hvis dette er umuligt, skal du stoppe med at bruge den og kontakte din leverandør. Naturligvis skal ventilen på beholderen være lukket efter hver brug..
Den nævnte beholder skal holdes lukket, selv når den er tom. Flamme eller lokal varme må aldrig påføres direkte på nogen del af beholderen. Høje temperaturer kan beskadige beholderen og få trykaflastningsanordningen til at svigte for tidligt og udlufte beholderens indhold (praxair inkl., 2016).
Syntese
Hydrogenbromidgas kan fremstilles i laboratoriet ved at bromere tetralin (1,2,3,4-tetrahydronaphthalen). Ulempen er, at halvdelen af brom går tabt. Udbyttet er ca. 94%, eller hvad der er det samme, 47% af brom ender som HBr.
C10H12 + 4 Brto → C10H8Br4 + 4 HBr
Hydrogenbromidgas kan også syntetiseres i laboratoriet ved at omsætte koncentreret svovlsyre med natriumbromid..
NaBr (s) + HtoSW4 → HBr (g) + NaHSO4
Ulempen ved denne metode er, at meget af produktet går tabt ved oxidation med overskydende svovlsyre til dannelse af brom og svovldioxid..
2 HBr + HtoSW4 → Brto + SWto + 2 timertoELLER
Hydrogenbromid kan fremstilles i laboratoriet ved reaktion mellem oprenset hydrogengas og brom. Dette katalyseres af platinasbest og udføres i et kvartsrør ved 250 ° C.
Brto + Hto[Pt] → 2 HBr
Vandfrit hydrogenbromid kan også fremstilles i lille skala ved termolyse af triphenylphosphoniumbromid i xylen under tilbagesvaling..
HBr kan opnås ved den røde fosformetode. Først tilsættes det røde fosfor i vandreaktoren og senere langsomt brom under omrøring og reaktionen mellem brombrintesyre og fosforsyre ved sedimentering, filtrering og den opnåede destillation vil være brombrinsyre..
P4+6 Brto+12 timertoO → 12 HBr + 4 H3PO3
Hydrogenbromid fremstillet ved ovenstående fremgangsmåder kan blive forurenet med Brto, som kan fjernes ved at føre gassen gennem en opløsning af phenol i tetrachlormethan eller andet egnet opløsningsmiddel ved stuetemperatur, hvorved der produceres 2, 4, 6-tribromphenol og derved genereres mere HBr.
Denne proces kan også udføres gennem kobberchips med høj temperatur eller kobbergas (Hydrogen: hydrogenbromid, 1993-2016).
Ansøgninger
HBr anvendes til fremstilling af organiske bromider, såsom methylbromid, bromethan osv., Og uorganiske, såsom natriumbromid, kaliumbromid, lithiumbromid og calciumbromid osv..
Det bruges også i fotografiske og farmaceutiske applikationer eller til syntese af beroligende midler og anæstetika. Derudover anvendes det i industriel tørring, tekstilfinish, coatingmidler, overfladebehandling og brandsikringsmidler..
Forbindelsen bruges også til at ætse polysiliciumplader til fremstilling af computerchips (Interscan Corporation, 2017).
Hydrogenbromid er et godt opløsningsmiddel til nogle metalmalme, der anvendes til raffinering af metaller med høj renhed.
I olieindustrien anvendes det som en adskillelse af alkoxy- og phenoxyforbindelser og en katalysator til oxidation af cykliske carbonhydrider og kædecarbonhydrider til ketoner, syre eller peroxid. Det bruges også i syntetiske farvestoffer og krydderier..
En gas af høj kvalitet af HBr bruges til ætsning og rengøring af halvlederråmateriale (SHOWA DENKO K.K, n.d.).
Forbindelsen anvendes som et analytisk reagens til bestemmelse af svovl, selen, bismut, zink og jern til separering af tin fra arsen og antimon. Det er en alkyleringskatalysator og et reduktionsmiddel, der anvendes i organisk syntese.
Hydrogenbromid kan anvendes til produktion af brombrintesyre. Hydrobromsyre er en meget stærk mineralsyre, stærkere end saltsyre.
HBr er meget reaktiv og ætsende for de fleste metaller. Syre er et almindeligt reagens inden for organisk kemi, der anvendes til oxidation og katalyse. Det er også effektivt ved ekstraktion af visse metalliske mineraler (Hydrogenbromide, 2016).
Referencer
- Interscan Corporation. (2017). Hydrogenbromid- og hydrogenbromidovervågningsinstrumentering. Hentet fra gasdetection.com.
- Kemisk datablad. (2016). Hentet fra HYDROGEN BROMIDE, ANHYDROUS: cameochemicals.noaa.gov.
- Egon Wiberg, N. W. (2001). Uorganisk kemi. Akademisk presse.
- Brintbromid. (2016). Hentet fra ChemicalBook.
- Brint: hydrogenbromid. (1993-2016). Hentet fra WebElements.
- Sikkerhedsdatablad Hydrogenbromid. (2005, 9. oktober). Hentet fra sciencelab.com.
- National Center for Biotechnology Information. (S.F.). PubChem Compound Database; CID = 260. Hentet fra pubchem.ncbi.nlm.nih.gov.
- Praxair Inc. (2016, 17. oktober). Brintbromid, vandfrit sikkerhedsdatablad P-4605. Hentet fra praxair.com.
- SHOWA DENKO K.K. (s.f.). hydrogenbromid. Hentet fra www.sdk.co.jp.



Endnu ingen kommentarer