
Sølvbromid (AgBr) struktur, egenskaber og anvendelser
Det sølvbromid det er et uorganisk salt, hvis kemiske formel er AgBr. Dens faste stof består af kationer Ag+ og br anioner- i forholdet 1: 1, tiltrukket af elektrostatiske kræfter eller ionbindinger. Det kan ses som om metallisk sølv havde givet en af dens valenselektroner til molekylært brom.
Dets natur ligner dets "søskende" sølvchlorid og iodid. Alle tre salte er uopløselige i vand, har lignende farver og er også følsomme over for lys; det vil sige, de gennemgår fotokemiske reaktioner. Denne egenskab er blevet brugt til at opnå fotografier som et resultat af reduktionen af Ag-ioner+ til metallisk sølv.
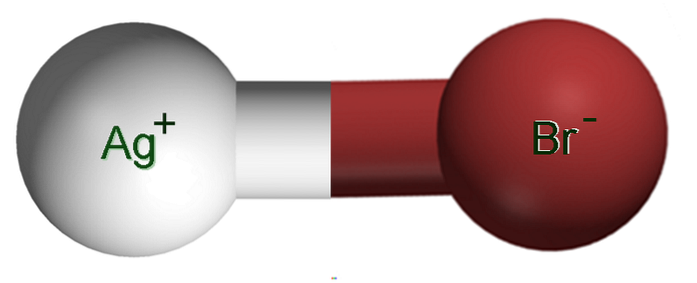
Billedet ovenfor viser et ionpar Ag+Br-, hvor de hvide og brune kugler svarer til Ag-ioner+ og Br-, henholdsvis. Her repræsenterer de den ioniske binding som Ag-Br, men det er nødvendigt at indikere, at der ikke er en sådan kovalent binding mellem begge ioner.
Det kan virke modstridende, at sølv er den, der bidrager med den sorte farve til fotografier uden farve. Dette skyldes, at AgBr reagerer med lys og genererer et latent billede; som derefter intensiveres ved at øge reduktionen af sølv.
Artikelindeks
- 1 Struktur af sølvbromid
- 1.1 Krystalfejl
- 2 Syntese
- 3 egenskaber
- 3.1 Udseende
- 3.2 Molekylær masse
- 3.3 Tæthed
- 3.4 Smeltepunkt
- 3.5 Kogepunkt
- 3.6 Opløselighed i vand
- 3.7 Brydningsindeks
- 3.8 Varmekapacitet
- 3.9 Følsomhed over for lys
- 4 anvendelser
- 5 Referencer
Struktur af sølvbromid
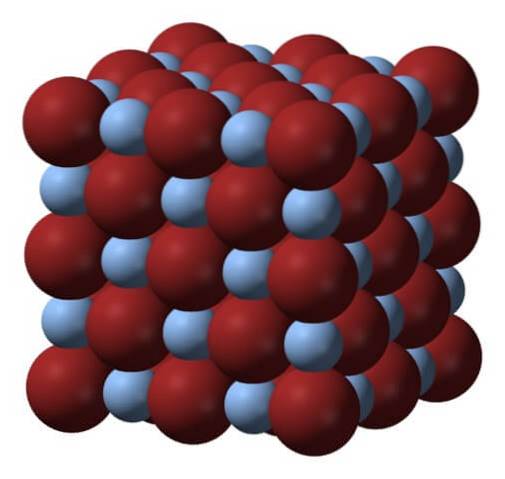
Ovenfor er gitteret eller krystalstrukturen af sølvbromid. Her er en mere trofast gengivelse af forskellen i størrelse mellem de ioniske radier af Ag+ og Br-. Br anioner-, mere voluminøse efterlader de mellemrum, hvor Ag-kationerne er placeret+, som er omgivet af seks Br- (og omvendt).
Denne struktur er karakteristisk for et kubisk krystallinsk system, specifikt af typen rock salt; det samme for eksempel som for natriumchlorid, NaCl. Faktisk letter billedet dette ved at arrangere en perfekt kubisk grænse.
Ved første øjekast kan det ses, at der er en vis forskel i størrelse mellem ionerne. Dette og måske de elektroniske egenskaber ved Ag+ (og den mulige virkning af nogle urenheder) fører til AgBr-krystaller, der viser defekter; det vil sige steder hvor rækkefølgen af ioner i rummet er "brudt".
Krystalfejl
Disse mangler består af hulrum, der er tilbage af fraværende eller fortrængte ioner. For eksempel mellem seks Br-anioner- normalt skal kationen Ag være+; men i stedet kan der være et tomrum på grund af at sølvet er flyttet ind i et andet hul (Frenkel-defekt).
Selvom de påvirker krystalgitteret, favoriserer de reaktionerne fra sølv med lys; og jo større krystaller eller deres klynge (størrelse af korn), jo større antal defekter, og derfor vil det være mere følsomt over for lys. På samme måde påvirker urenheder strukturen og denne egenskab, især dem, der kan reduceres med elektroner..
Som en konsekvens af sidstnævnte kræver store AgBr-krystaller mindre eksponering for lys for at reducere dem; de er mere ønskelige til fotografiske formål.
Syntese
I laboratoriet kan sølvbromid syntetiseres ved at blande en vandig opløsning af sølvnitrat, AgNO3, med saltet af natriumbromid, NaBr. Det første salt bidrager med sølvet, og det andet bromid. Det følgende er en dobbelt forskydnings- eller metatesereaktion, der kan repræsenteres af nedenstående kemiske ligning:
AgNO3(aq) + NaBr (s) => NaNO3(aq) + AgBr (s)
Bemærk, at natriumnitratsaltet, NaNO3, det er opløseligt i vand, mens AgBr udfældes som et fast stof med en svag gul farve. Derefter vaskes det faste stof og underkastes vakuumtørring. Ud over NaBr kunne KBr også bruges som en kilde til bromidanioner.
På den anden side kan AgBr naturligt opnås gennem dets mineralbromirit og dets rette oprensningsprocesser..
Ejendomme
Udseende
Lerlignende, hvidgult fast stof.
Molekylær masse
187,77 g / mol.
Massefylde
6,473 g / ml.
Smeltepunkt
432 ° C.
Kogepunkt
1502 ° C.
Vandopløselighed
0,140 g / ml ved 20 ° C.
Brydningsindeks
2.253.
Varmekapacitet
270 J / kg K.
Følsomhed over for lys
Det blev sagt i det foregående afsnit, at der er defekter i AgBr-krystaller, der fremmer følsomheden af dette salt over for lys, da de fælder de dannede elektroner; og således er de i teorien forhindret i at reagere med andre arter i miljøet, såsom ilt i luften.
Elektronen frigøres fra Br-reaktionen- med en foton:
Br- + hv => 1 / 2Brto + og-
Bemærk, at Br produceresto, som pletter det faste rødt, hvis det ikke fjernes. Udgivne elektroner reducerer Ag-kationer+, i dets mellemrum til metallisk sølv (undertiden repræsenteret som Ag0):
Ag+ + og- => Ag
Efter at have netligningen:
AgBr => Ag + 1 / 2Brto
Når de "første lag" af metallisk sølv dannes på overfladen, siges det at der er et latent billede, der stadig er usynligt for det menneskelige øje. Dette billede bliver millioner af gange mere synligt, hvis en anden kemisk art (såsom hydroquinon og phenidon i udviklingsprocessen) øger reduktionen af AgBr-krystaller til metallisk sølv.
Ansøgninger

Sølvbromid er den mest anvendte af alle dets halogenider inden for fotografisk filmudvikling. AgBr påføres filmene, fremstillet med celluloseacetat, suspenderet i gelatine (fotografisk emulsion) og i nærvær af 4- (methylamino) phenolsulfat (Metol) eller phenidon og hydroquinon.
Med alle disse reagenser kan det latente billede bringes til live; afslut og fremskynde omdannelsen af ionisk til metallisk sølv. Men hvis du ikke fortsætter med en vis omhu og erfaring, oxiderer alt sølv på overfladen, og kontrasten mellem de sorte og hvide farver slutter..
Derfor er stop-, fikserings- og vaskedypningstrin i fotografiske film meget vigtige..
Der er kunstnere, der leger med disse processer på en sådan måde, at de skaber gråtoner, som beriger billedets skønhed og deres egen arv; og de gør alt dette, undertiden måske uden mistanke om det takket være kemiske reaktioner, hvis teoretiske grundlag kan blive lidt kompleks, og til en lysfølsom AgBr, der markerer et udgangspunkt.
Referencer
- Wikipedia. (2019). Sølvbromid. Gendannet fra: en.wikipedia.org
- Michael W. Davidson. (2015, 13. november). Polariseret lys digitalt billedgalleri: Sølvbromid. Olympus. Gendannet fra: micro.magnet.fsu.edu
- Crystran Ltd. (2012). Sølvbromid (AgBr). Gendannet fra: crystran.co.uk
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann og Claudia Schneeweiss. (29. juni 2004). Selvfremstillede sølvbromidbaserede emulsioner til brugere i holografi: fremstilling, forarbejdning og anvendelse, Proc. SPIE 5290, Praktisk holografi XVIII: Materialer og applikationer; doi: 10.1117 / 12.525035; https://doi.org/10.1117/12.525035
- Alan G. Form. (1993). Uorganisk kemi. (Anden version.). Redaktionel Reverté.
- Carlos Güido og Ma Eugenia Bautista. (2018). Introduktion til fotografisk kemi. Gendannet fra: fotografia.ceduc.com.mx
- García D. Bello. (9. januar 2014). Kemi, fotografering og Chema Madoz. Gendannet fra: dimethylsulfuro.es



Endnu ingen kommentarer