
Butanonstruktur, egenskaber og anvendelser
Det butanon er en organisk forbindelse, specifikt en keton, hvis kemiske formel er CH3CHtoBil3. Dens udseende ser ud som en farveløs væske, der primært anvendes som opløsningsmiddel. Har egenskaber svarende til acetone, men koger ved en højere temperatur og fordamper langsommere.
Det produceres ved katalytisk dehydrogenering af 2-butanol (chiral forbindelse). Det findes dog i sin naturlige tilstand i sammensætningen af nogle frugter. Det er en del af dampene fra køretøjers udstødningsrør og er en komponent i tobaksrøg.
Det er efter acetone den enkleste af denne familie af organiske forbindelser. Butanon forårsager irritation i øjne og næse. Ved usædvanligt høje doser kan det forårsage irritation af lungeslimhinden. På den anden side betragtes denne væske som et forløbermiddel til narkotika..
Butanon har stor opløselighed i vand; men det er også meget opløseligt i organiske opløsningsmidler, såsom ethanol, ether, acetone, benzen og chloroform. Dette kunne forklares, fordi din log af P (0,29) -værdien for oktan / vand-fordelingskoefficienten er lav.
Artikelindeks
- 1 Struktur af butanon
- 2 egenskaber
- 2.1 Molekylær formel
- 2.2 Navne
- 2.3 Molær masse
- 2.4 Fysisk beskrivelse
- 2,5 Lugt
- 2.6 Kogepunkt
- 2.7 Smeltepunkt
- 2.8 Flammepunkt
- 2.9 Opløselighed i vand
- 2.10 Opløselighed i organiske opløsningsmidler
- 2.11 Tæthed
- 2.12 Dampmassefylde
- 2.13 Damptryk
- 2.14 Fordelingskoefficient for oktanol / vand
- 2.15 Selvantændelsestemperatur
- 2.16 Nedbrydning
- 2.17 Viskositet
- 2.18 Forbrændingsvarme
- 2.19 Fordampningsvarme
- 2.20 Overfladespænding
- 2.21 Ioniseringspotentiale
- 2.22 Lugttærskel
- 2.23 Brydningsindeks
- 2.24 Dissociationskonstant
- 2.25 Stabilitet
- 3 anvendelser
- 3.1 Opløsningsmiddel
- 3.2 Reagens
- 3.3 Plastcement
- 3.4 Andre anvendelser
- 4 Referencer
Struktur af butanon
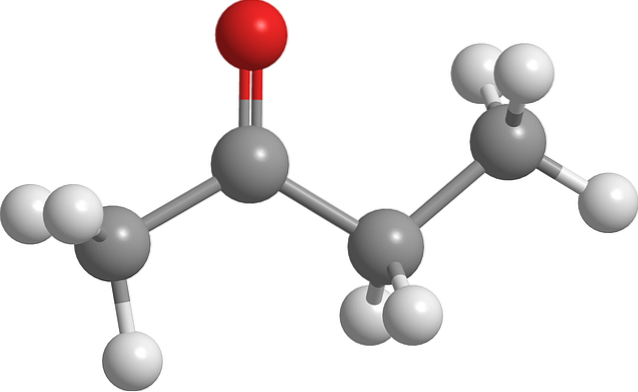
Billedet ovenfor viser butanonmolekylet med en kugle-og-stick-model. Oxygenatomet i carbonylgruppen (rød kugle) kan ses på det andet carbon. Denne gruppe, C = O, er ansvarlig for at give molekylet et permanent dipolmoment.
Butanon, strukturelt set, er intet andet end en acetone, hvortil der er tilsat en methylengruppe, CHto. Da der er flere carbonatomer, er dipolmomentet mindre sammenlignet med acetone; men dens højere molekylære masse får det til at koge ved en højere temperatur.
Dette molekyle, som andre ketoner, mangler evnen til at danne hydrogenbindinger; og derfor er deres dipol-dipol-interaktioner ikke så stærke.
Derfor er det en flygtig væske. Når temperaturen falder (-86,6 ° C), er dens svage dipoler dem, der orienterer dets molekyler på en ordnet måde for at danne en krystal. Ud over dette kan det også kommenteres, at butanon er strukturelt asymmetrisk.
Ejendomme
Molekylær formel
C4H8O eller CH3BiltoCH3
Navne
- Butanon.
- 2-butanon.
- Butan-2-one.
- Methylethylketon.
Molar masse
72,107 g / mol.
Fysisk beskrivelse
Farveløs væske.
Lugt
Mint duftende, moderat stærk.
Kogepunkt
79,59 ° C ved 760 mmHg.
Smeltepunkt
-86,6 ºC.
antændelsespunkt
-9 ºC (lukket kop).
Vandopløselighed
29 g / 100 ml ved 20 ° C Selvom dens dipolmoment er mindre end acetone, kan det stadig interagere i fremragende grad med vandmolekyler. Fra dem modtager den hydrogenbindinger: (CH3(CHtoCH3C = O-HOH. På grund af dette er det meget opløseligt i vand.
Opløselighed i organiske opløsningsmidler
Opløselig i benzen, alkohol og ether; Blandbar med olier, ethanol, ether, acetone, benzen og chloroform. Bemærk, at butanon er opløselig i en lang række opløsningsmidler.
Massefylde
0,7997 g / cm3 ved 25 ºC.
Dampmassefylde
2,41 (i forhold til vand = 1).
Damptryk
90,6 mmHg ved 25 ºC.
Fordelingskoefficient for oktanol / vand
Log P = 0,29
Selvantændelsestemperatur
505 ºC.
Nedbrydning
Det nedbrydes ved fotokemiske processer gennem oxidation af frie hydroxylradikaler såvel som ved direkte fotolyse-nedbrydning. Når den opvarmes til nedbrydning, udsender den skarp røg.
Viskositet
0,40 cPoise ved 25 ° C.
Forbrændingsvarme
2.444,1 kJ / mol ved 25 ºC.
Fordampningsvarme
31.30 kJ / mol ved kogepunkt; og 34,79 kJ / mol ved 25 ºC.
Overfladespænding
23,97 mN / m ved 25 ºC.
Ioniseringspotentiale
0,54 eV.
Lugtgrænse
Lav lugt: 0,735 mg / m3.
Høj lugt: 147,5 mg / m3.
Brydningsindeks
1.788 ved 20 ºC.
Dissociation konstant
pKa = 14,70.
Stabilitet
Stabil, men meget brandfarlig. Uforenelig med stærke oxidationsmidler, baser og reduktionsmidler. Fugt bør undgås.
Ansøgninger
Opløsningsmiddel
Butanon anvendes som opløsningsmiddel til fremstilling af overfladebelægninger, fremstilling af røgfri pulvere, fremstilling af farvede harpikser og til fjernelse af fedtophobning produceret af smøremidler.
Derudover bruges det til udarbejdelsen af:
- Kunstlæder.
- Gummi.
- Lak.
- Lakker.
- Lim.
- Opløsningsmidler.
- Fjernelse af maling.
- Klæbemidler.
- Plastcementer.
- Tætningsmidler.
- Magnetbånd.
- Gennemsigtigt papir.
- Trykfarver.
- Kosmetik og lægemidler.
Det bruges også som opløsningsmiddel til affedtning af metaloverflader, rengøringsmidler til elektronisk udstyr og fedtudvinding. Det bruges til ekstraktion af hårdttræ og vegetabilsk olie.
Det er en inaktiv ingrediens ved fremstilling af pesticider og til fremstilling af celluloseacetat og cellulosenitrat.
Det bruges som et ekstraktionsopløsningsmiddel ved forarbejdning af fødevarer og fødevareingredienser; for eksempel i fraktionering af fedt og olier såvel som i koffeinfremstillingsprocessen for kaffe. Anvendes også som opløsningsmiddel i markører, der bruges på tavler.
Reagens
- Butanon anvendes som en vandopløselig fotoinitiator til fotopolymerisation af methacrylsyre..
- Det kondenseres med formaldehyd til dannelse af isopropenylketon.
- Oplever selvkondensering til produktion af ethylamylketon.
- Reagerer med citral for at opnå parfume komponenter som methylpseudoionon.
- Gribe ind som en katalysator i produktionen af hydrazin.
- Derudover er det en forløber for methylethylketonperoxid, som er en katalysator for nogle polymerisationsreaktioner..
Plastcement
Butanon kan anvendes som et plastsvejsemiddel med anvendelse i samlingen af polystyrenskalamodeller. Butanon opløser polystyren, så kanterne kan komme sammen, når der opstår en ny polymerisering. Denne adfærd er af en cement og ikke af en lim.
Andre anvendelser
Butanon bruges som en bakteriel spore-sterilisator i kirurgiske instrumenter, nåle, injektionsvæsker og tandinstrumenter..
Det bruges som et smagsstof til fødevarer i meget lave koncentrationer; for eksempel i alkoholholdige drikkevarer er koncentrationen 20 ppm; i bagte produkter, 12,7 ppm; kød har omkring 26,5 ppm; tyggegummi, 0,63 ppm; og i fedt og olier, 1,0 ppm.
Og endelig anvendes butanon til adskillelsen af apoproteinet fra hæmgruppen i hæmeproteinerne..
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5ta Udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10thudgave.). Wiley plus.
- National Center for Biotechnology Information. (2019). Methylethylketon PubChem Database. CID = 6569. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Butanon. Gendannet fra: en.wikipedia.org
- Royal Society of Chemistry. (2015). Butanon. Chemspider. Gendannet fra: chemspider.com
- Arlem Cheprasov. (2019). Hvad er butanon? Formel og anvendelser. Undersøgelse. Gendannet fra: study.com
- Vasler Ben. (17. maj 2017). Butanon. Chemistry World. Gendannet fra: chemistryworld.com


Endnu ingen kommentarer