
Butino struktur, egenskaber og anvendelser

Det butino er en kemisk forbindelse, der hører til gruppen af alkyner, der hovedsagelig er kendetegnet ved at have i sin struktur mindst en tredobbelt binding mellem to carbonatomer.
Når det gælder etablering af regler for navngivning af alkyner, har IUPAC (International Union of Pure and Applied Chemistry) fastslået, at de samme regler anvendes som for alkener..

Den grundlæggende forskel mellem nomenklaturen for begge typer stoffer er, at suffikset -eno ændres til -ino, når det kommer til forbindelser, der har tredobbelt binding i deres struktur..
På den anden side består butyne udelukkende af kulstof og brint og forekommer i to former: 1-butyne, som er i gasfasen under standardtryks- og temperaturbetingelser (1 atm, 25 ° C); og 2-butyne, som er en art i flydende fase produceret ved kemisk syntese.
Artikelindeks
- 1 Kemisk struktur
- 1.1 1-butyne
- 1.2 2-butyne
- 2 egenskaber
- 3 anvendelser
- 4 Referencer
Kemisk struktur
I molekylet kendt som butyne forekommer fænomenet strukturel positionisomerisme, som består af tilstedeværelsen af de samme funktionelle grupper i begge forbindelser, men hver af disse findes på et andet sted i kæden..
I dette tilfælde har begge former for butyne en identisk molekylformel; i 1-butyne er den tredobbelte binding imidlertid placeret på kulstof nummer et, mens den i 2-butyne er placeret på nummer to. Dette omdanner dem til positionelle isomerer.
På grund af placeringen af den tredobbelte binding i en af terminalerne i 1-butyn-strukturen betragtes den som en terminal alkyn, mens den mellemliggende position af den tredobbelte binding i 2-butyn-strukturen giver den klassificeringen af intern alkyn.
Således kan bindingen kun være mellem det første og andet carbon (1-butyne) eller mellem det andet og tredje carbon (2-butyne). Dette skyldes den anvendte nomenklatur, hvor den lavest mulige nummerering altid vil blive givet til positionen for den tredobbelte binding..
1-butyne
Forbindelsen kaldet 1-butyne er også kendt som ethylacetylen på grund af dens struktur og den måde, hvorpå de fire carbonatomer er arrangeret og bundet. Men når man taler om butino der henvises kun til denne kemiske art.
I dette molekyle er den tredobbelte binding ved et terminal kulstof, som tillader tilgængeligheden af hydrogenatomer, der giver den stor reaktivitet.
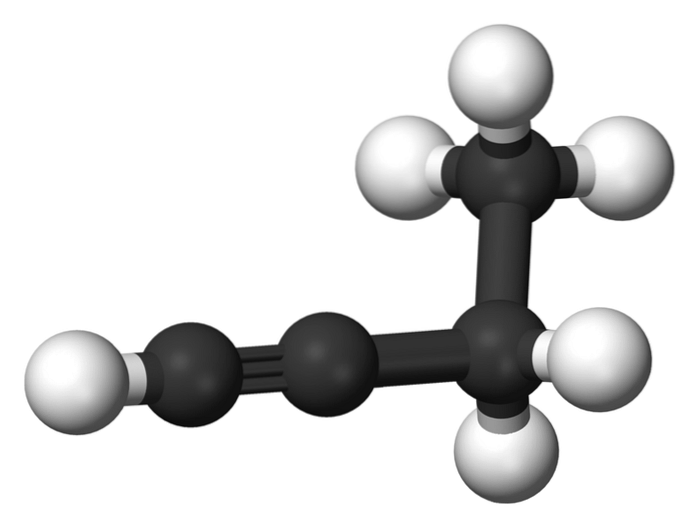
Denne stive og stærkere binding end en enkelt- eller dobbeltbinding mellem carbonatomer giver en stabil konfiguration af lineær geometri til 1-butyne..
På den anden side er dette gasformige stof ret brandfarligt, så i nærvær af varme kan det let forårsage brande eller eksplosioner og har stor reaktivitet i nærvær af luft eller vand..
2-butyne
Da interne alkyner udviser større stabilitet end terminale alkyner, tillader de transformation af 1-butyne til 2-butyne.
Denne isomerisering kan forekomme ved opvarmning af 1-butyne i nærværelse af en base (såsom NaOH, KOH, NaOCH3 ...) eller gennem omlejring af 1-butyne i en opløsning af kaliumhydroxid (KOH) i ethanol (CtoH6ELLER).
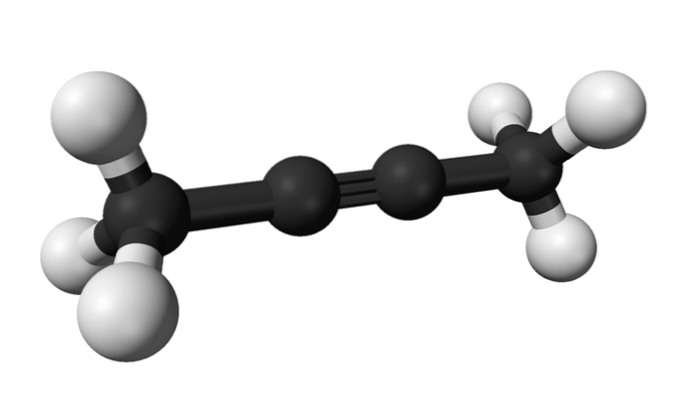
På samme måde kaldes det kemiske stof kendt som 2-butyne også dimethylacetylen (eller crotonylen), der præsenterer sig selv som en flydende og flygtig art, der stammer kunstigt..
I 2-butyne findes den tredobbelte binding midt i molekylet, hvilket giver den større stabilitet end dens isomer.
Derudover har denne farveløse forbindelse en lavere densitet end vand, selvom den betragtes som uopløselig i den og har høj antændelighed..
Ejendomme
-Den strukturelle formel for butyne (uanset hvilken isomer der henvises til) er C4H6, som har en lineær struktur.
-En af de kemiske reaktioner, som butynmolekylet gennemgår, er isomerisering, hvor en omlejring og migration af den tredobbelte binding finder sted inden i molekylet..
-1-butyne er i luftform, har en meget høj antændelighed og en højere densitet end luft.
-Dette stof er også ret reaktivt, og i nærvær af varme kan det forårsage voldelige eksplosioner..
-Derudover, når denne farveløse gas gennemgår en ufuldstændig forbrændingsreaktion, kan den forårsage kulilte (CO).
-Når begge isomerer udsættes for høje temperaturer, kan de gennemgå eksplosive polymerisationsreaktioner..
-2-Butyne er i flydende fase, selvom det også betragtes som ganske brandfarligt under standardbetingelser for tryk og temperatur..
-Disse stoffer kan gennemgå voldsomme reaktioner, når de er i nærvær af stærke oxiderende stoffer..
-På samme måde, når de er i nærværelse af reducerende arter, forekommer eksoterme reaktioner med en deraf følgende frigivelse af hydrogengas..
-Ved kontakt med visse katalysatorer (såsom nogle sure stoffer) eller initierende arter kan der forekomme eksoterme polymerisationsreaktioner.
Ansøgninger
Fordi de har nogle forskellige egenskaber, kan begge isomerer have forskellige anvendelser og applikationer, som vist nedenfor:
For det første er en af anvendelserne af 1-butyne meget ofte anvendelsen heraf som et mellemliggende trin i produktionsprocessen af andre stoffer af organisk natur af syntetisk oprindelse..
På den anden side anvendes denne kemiske art i gummiproduktionsindustrien og afledte forbindelser; som for eksempel når du ønsker at få benzol.
På en lignende måde bruges det i fremstillingsprocessen af et stort udvalg af plastprodukter såvel som i udarbejdelsen af mange polyethylenstoffer, der betragtes som høj densitet..
Også 1-butyne bruges ofte som en komponent til skære- og svejseprocesserne i nogle metallegeringer, herunder stål (jern-kulstoflegering)..
I en anden forstand bruges 2-butyn-isomeren i kombination med en anden alkyn kaldet propyn i syntesen af nogle stoffer kendt som alkylerede hydroquinoner, når den samlede synteseproces af a-tocopherol (vitamin E) udføres..
Referencer
- Wikipedia. (s.f.). Butyne. Gendannet fra en.wikipedia.org
- Yoder, C. H., Leber P. A. og Thomsen, M. W. (2010). Broen til organisk kemi: begreber og nomenklatur. Gendannet fra books.google.co.ve
- Study.com. (s.f.). Butyne: Structural Formula & Isomers. Hentet fra undersøgelsen.
- PubChem. (s.f.). 1-Butyne. Gendannet fra pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butyne. Hentet fra pubchem.ncbi.nlm.nih.gov



Endnu ingen kommentarer