
Varmeformler og enheder, egenskaber, hvordan man måler det, eksempler
Det hed i fysik er det defineret som overført varmeenergi når genstande eller stoffer, der har forskellige temperaturer, kommer i kontakt. Denne energioverførsel og alle de processer, der er relateret til den, er genstand for undersøgelse af termodynamik, en vigtig gren af fysikken..
Varme er en af de mange former, som energi tager, og en af de mest velkendte. Så hvor kommer det fra? Svaret ligger i atomer og molekyler, der udgør stof. Disse partikler inde i tingene er ikke statiske. Vi kan forestille os dem som små perler forbundet med bløde fjedre, der let kan krympe og strække..
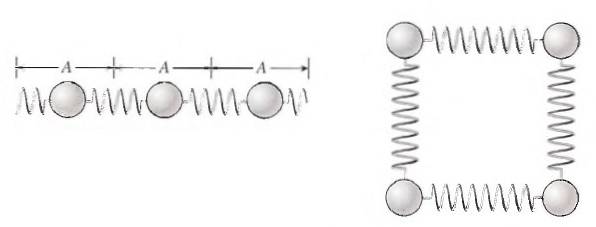
På denne måde er partiklerne i stand til at vibrere, og deres energi kan let overføres til andre partikler og også fra en krop til en anden..
Mængden af varme, som et legeme absorberer eller giver op, afhænger af stoffets art, dets masse og temperaturforskellen. Det beregnes således:
Q = m.Cog .AT
Hvor Spørgsmål er mængden af varme, der overføres, m er genstandens masse, Cog er stoffets specifikke varme AT = Tendelig - Tinitial, det vil sige temperaturforskellen.
Som alle former for energi måles varme i joules, i det internationale system (SI). Andre egnede enheder er: ergs i cgs-system, Btu i det britiske system og kalorie, et almindeligt anvendt udtryk for fødevares energiindhold.
Artikelindeks
- 1 Egenskaber for varme
- 1.1 Termisk ligevægt og energibesparelse
- 2 Hvordan måles varmen?
- 2.1 Hvad kræves for at lave et termometer?
- 2.2 Temperaturskalaer
- 3 eksempler
- 4 Øvelser
- 4.1 - Øvelse 1
- 4.2 - Øvelse 2
- 5 Referencer
Varmeegenskaber

Der er flere nøglebegreber at huske på:
-Varme handler om energi i transit. Objekterne har ikke varme, de giver den kun eller absorberer den i henhold til omstændighederne. Hvad genstande har er intern energi, i kraft af sin interne konfiguration.
Denne interne energi er til gengæld sammensat af kinetisk energi forbundet med vibrationsbevægelse og potentiel energi, typisk for den molekylære konfiguration. Ifølge denne konfiguration vil et stof overføre varme mere eller mindre let, og dette reflekteres i dets specifikke varme Cog, den værdi, der blev nævnt i ligningen for at beregne Q.
-Det andet vigtige koncept er, at varmen altid overføres fra den varmere krop til den koldere. Erfaringen indikerer, at varmen fra varm kaffe altid passerer mod koppen og tallerkenens porcelæn eller metallet i den ske, som den omrøres med, aldrig omvendt..
-Mængden af varme, der overføres eller absorberes, afhænger af kroppens masse. Tilføjelse af den samme mængde kalorier eller joule til en prøve med X-masse opvarmes ikke på samme måde en anden, hvis masse er 2X.
Grunden? Der er flere partikler i den større prøve, og hver modtager i gennemsnit kun halvdelen af energien i den mindre prøve..
Termisk ligevægt og energibesparelse
Erfaringen fortæller os, at når vi sætter to objekter i forskellige temperaturer i kontakt, efter et stykke tid vil temperaturen på begge være den samme. Derefter kan det bekræftes, at objekterne eller systemerne, som de også kan kaldes, er i termisk ligevægt.
På den anden side, der reflekterer over, hvordan man øger den indre energi i et isoleret system, konkluderes det, at der er to mulige mekanismer:
i) Opvarmning af det, dvs. overførsel af energi fra et andet system.
ii) Udfør en slags mekanisk arbejde på det.
Under hensyntagen til, at energi er bevaret:
Enhver stigning i systemets interne energi er lig med mængden af tilsat varme plus det arbejde, der er udført på det..
Inden for rammerne af termodynamik er dette bevarelsesprincip kendt som Første lov om termodynamik. Vi siger, at systemet skal isoleres, for ellers ville det være nødvendigt at overveje andre energiindgange eller -udgange i balancen.
Hvordan måler du varme?
Varme måles i henhold til den effekt, den producerer. Derfor er det berøringsfølelsen, der hurtigt informerer, hvor varm eller kold en drink, en mad eller en hvilken som helst genstand er. Da overførsel eller absorbering af varme resulterer i temperaturændringer, giver måling af dette en idé om, hvor meget varme der er overført.
Instrumentet til måling af temperatur er termometeret, en enhed udstyret med en gradueret skala til at udføre aflæsningen. Det mest kendte er kviksølvtermometeret, der består af en fin kapillær af kviksølv, der udvides, når den opvarmes.

Derefter indsættes den kviksølvfyldte kapillær i et glasrør med en skala og sættes i kontakt med kroppen, hvis temperatur skal måles, indtil de når termisk ligevægt, og temperaturen på begge er den samme..
Hvad der kræves for at lave et termometer?
Til at begynde med kræves det at have en eller anden termometrisk egenskab, det vil sige en, der varierer med temperaturen.
For eksempel ekspanderer en gas eller en væske, såsom kviksølv, når den opvarmes, skønt en elektrisk modstand også tjener, som udsender varme, når en strøm passerer igennem den. Kort sagt kan enhver termometrisk egenskab, der er let målelig, bruges.
Hvis temperaturen t er direkte proportional med den termometriske egenskab x, så kan du skrive:
t = kX
Hvor k er den proportionalitetskonstant, der skal bestemmes, når der indstilles to passende temperaturer og de tilsvarende værdier på x. Passende temperaturer betyder let at opnå i laboratoriet.
Når parene er oprettet (t1, x1) Y (tto, xto), del intervallet mellem dem i lige store dele, disse vil være graderne.
Temperaturskalaer
Valget af de temperaturer, der er nødvendige for at konstruere en temperaturskala, foretages ud fra kriteriet, at de er lette at opnå i laboratoriet. En af de mest anvendte skalaer rundt om i verden er Celsius-skalaen, skabt af den svenske videnskabsmand Anders Celsius (1701-1744).
0 på Celsius-skalaen er den temperatur, hvor is og flydende vand er i ligevægt ved 1 trykatmosfære, mens den øvre grænse vælges, når flydende vand og vanddamp er lige i ligevægt og ved 1 atmosfære af tryk. Dette interval er opdelt i 100 grader, som hver kaldes grad celsius.
Dette er ikke den eneste måde at opbygge en skala på, langt fra den. Der er andre forskellige skalaer, såsom Fahrenheit-skalaen, hvor intervallerne er valgt med andre værdier. Og der er Kelvin-skalaen, som kun har en nedre grænse: absolut nul..
Absolut nul svarer til temperaturen, hvor al bevægelse af partikler i et stof ophører fuldstændigt, men selvom det er kommet ret tæt, har det endnu ikke været muligt at afkøle noget stof til absolut nul..
Eksempler
Alle oplever varme dagligt, enten direkte eller indirekte. For eksempel når du tager en varm drink i middagssolen, undersøger temperaturen på en bilmotor, i et overfyldt rum og i utallige andre situationer..

På Jorden er varme nødvendig for at opretholde livsprocesser, både det der kommer fra Solen og det der kommer fra det indre af planeten..
Ligeledes er klima drevet af ændringer i termisk energi, der opstår i atmosfæren. Solens varme når ikke overalt lige, ved ækvatoriale breddegrader når den mere end ved polerne, så den varmeste luft i troperne stiger og bevæger sig nord og syd for at opnå termisk ligevægt..

På denne måde etableres luftstrømme ved forskellige hastigheder, der transporterer skyer og regn. På den anden side forårsager den pludselige kollision mellem varme og kolde luftfronter fænomener som storme, tornadoer og orkaner..
I stedet for, på et nærmere niveau, er varmen muligvis ikke så velkommen som en solnedgang på stranden. Varme forårsager driftsproblemer i bilmotorer og computerprocessorer.
Det får også elektrisk energi til at gå tabt i ledningskabler og materialer til at ekspandere, hvorfor varmebehandling er så vigtig inden for alle tekniske områder.
Uddannelse
- Øvelse 1
En sliketiket læser, at den giver 275 kalorier. Hvor meget energi i joule er dette slik?
Opløsning
I begyndelsen var kalorien blevet nævnt som en enhed til varme. Fødevarer indeholder energi, der normalt måles i disse enheder, men kalorier i kosten er faktisk kilokalorier.
Ækvivalensen er følgende: 1 kcal = 4186 J, og det konkluderes, at sliket har:
275 kilokalorier x 4186 joule / kilokalorie = 1,15 106 J.
- Øvelse 2
100 g af et metal opvarmes til 100 ° C og anbringes i et kalorimeter med 300 g vand ved 20 ° C. Den temperatur, som systemet får, når det når ligevægt, er 21,44 ° C. Du bliver bedt om at bestemme metalets specifikke varme, forudsat at kalorimeteret ikke absorberer varme.
Opløsning
I denne situation afgiver metallet varmen, som vi kalder Qgav efter og et tegn (-) er forberedt for at indikere tab:
Spørgsmålgav efter = mmetal .EFmetal. AT
På sin side absorberer vandet i kalorimeteret varme, som vil blive betegnet som Q absorberet:
Spørgsmålabsorberet = mVand .EF Vand . AT
Energi er bevaret, hvoraf det følger, at:
Spørgsmålgav efter = Qabsorberet
Fra udsagnet kan du beregne AT:
Metal: AT = Tendelig - Tinitial= (21,44 - 100) ºC = -78,56 ºC = -78,56 K.
Vand: ΔT = Tendelig - Tinitial= (21,44 - 20) ºC = 1,44 ºC = 1,44 K.
Vigtig: 1 ºC har samme størrelse som 1 kelvin. Forskellen mellem begge skalaer er, at Kelvin-skalaen er absolut (Kelvin-grader er altid positive).
Den specifikke varme af vand ved 20 ° C er 4186 J / kg. K og med dette kan den absorberede varme beregnes:
Spørgsmålabsorberet = mVand .EF Vand . ΔT = 300 x 10-3 kg. 4186 J / kg. K. 1,44 K = 1808,35 J.
Afslutningsvis ryddes metalets specifikke varme:
EF metal = Q absorberet / -m metal . ΔT metal = 1808,35 J / - [(100 x 10-3 kg. (-78,56 K)] = 230,2 J / kg.K
Referencer
- Bauer, W. 2011. Fysik til ingeniørvidenskab. Bind 1. McGraw Hill.
- Cuellar, J.A. Fysik II: Kompetence tilgang. Mcgraw bakke.
- Kirkpatrick, L. 2007. Fysik: Et blik på verden. 6ta Forkortet udgave. Cengage læring.
- Knight, R. 2017. Fysik for forskere og teknik: en strategi tilgang. Pearson.
- Tippens, P. 2011. Fysik: begreber og applikationer. 7. udgave. Mcgraw bakke


Endnu ingen kommentarer