
Kalorimeterhistorie, dele, typer og deres egenskaber
Det kalorimeter er en enhed, der bruges til at måle temperaturændringen i en mængde stof (normalt vand) med kendt specifik varme. Denne temperaturændring skyldes varmen, der absorberes eller frigives i den undersøgte proces; kemisk, hvis det er en reaktion, eller fysisk, hvis det består af en fase- eller tilstandsændring.
I laboratoriet er det enkleste kalorimeter, der findes, kaffeglasets. Det bruges til at måle varmen absorberet eller frigivet i en reaktion under konstant tryk i vandig opløsning. Reaktionerne vælges for at undgå indblanding af reagenser eller gasformige produkter.
Mængden af varme, der afgives i reaktionen = den mængde varme, der absorberes af kalorimeteret + den mængde varme, der absorberes af opløsningen
Den mængde varme, der absorberes af kalorimeteret kaldes kalorimeterets kapacitet. Dette bestemmes ved at tilføre en kendt mængde varme til kalorimeteret med en given vandmasse. Derefter øges temperaturstigningen på kalorimeteret og den opløsning, der indeholder.
Med disse data og brugen af den specifikke vandvarme (4,18 J / g.ºC) kan kalorimeterets kalorikapacitet beregnes. Denne kapacitet kaldes også kalorimeterkonstanten.
På den anden side er den varme, der opnås med den vandige opløsning, lig med m · ce · At. I formlen m = vandmasse, ce = specifik vandvarme og Δt = temperaturvariation. Når du ved alt dette, kan du derefter beregne mængden af varme frigivet ved den eksoterme reaktion.
Artikelindeks
- 1 Kalorimeterets historie
- 2 dele
- 3 Typer og deres egenskaber
- 3.1 Glas kaffe
- 3.2 Den kalorimetriske bombe
- 3.3 Det adiabatiske kalorimeter
- 3.4 Isoperibol kalorimeter
- 3.5 Strømningskalorimeter
- 3.6 Kalorimeteret til differentiel scanningskalorimetri
- 4 applikationer
- 4.1 I fysisk-kemi
- 4.2 I biologiske systemer
- 4.3 Iltpumpekalorimeter og kalorieeffekt
- 5 Referencer
Kalorimeterets historie
I 1780 brugte A. L. Lavoisier, en fransk kemiker, der betragtes som en af kemiens fædre, et marsvin til at måle varmeproduktionen ved hjælp af åndedrættet..
Hvordan? Brug af en enhed svarende til et kalorimeter. Varmen, der produceres af marsvinet, fremgår af smeltningen af sneen, der omgav apparatet.
Forskere A. L Lavoisier (1743-1794) og P. S. Laplace (1749-1827) designede et kalorimeter, der blev brugt til at måle en legems specifikke varme ved metoden til at smelte is.
Kalorimeteret bestod af en cylindrisk, lakeret tinbæger, understøttet af et stativ og indvendigt afsluttet med en tragt. Inde i det blev der anbragt et andet glas svarende til det forrige med et rør, der krydsede det ydre kammer, og som var forsynet med en nøgle. Inde i det andet glas var der et gitter.
Væsenet eller objektet, hvis specifikke varme skulle bestemmes, blev placeret på dette gitter. Is blev placeret inde i de koncentriske briller, som i kurven.
Varmen produceret af kroppen blev absorberet af isen og fik den til at smelte. Og det flydende vandprodukt fra isens smeltning blev opsamlet og åbnede den indvendige vandhane.
Og endelig, vandet vejede, var massen af den smeltede is kendt.
Dele
Det mest anvendte kalorimeter i kemilæringslaboratorier er det såkaldte kaffekop kalorimeter. Dette kalorimeter består af et bægerglas eller i stedet en beholder med anime-materiale, der har visse isolerende egenskaber. Inde i denne beholder placeres den vandige opløsning sammen med kroppen, der skal producere eller absorbere varme.
Et låg lavet af isoleringsmateriale med to huller er placeret på den øverste del af beholderen. I det ene indsættes et termometer til måling af temperaturændringer, og i det andet en omrører, fortrinsvis lavet af glasmateriale, der udfører funktionen til at flytte indholdet af den vandige opløsning..
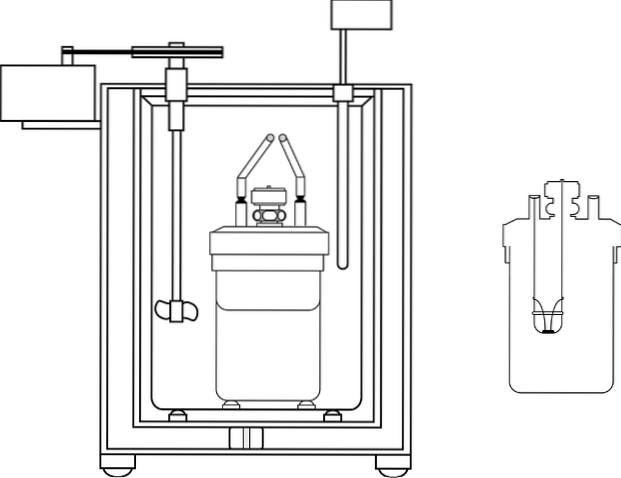
Billedet viser delene af en bombe kalorimeter; Det kan imidlertid ses, at det har termometeret og omrøreren, fælles elementer i flere kalorimetre.
Typer og deres egenskaber
Kop kaffe
Det er den, der bruges til bestemmelse af varmen frigivet ved en eksoterm reaktion, og varmen absorberet i en endoterm reaktion..
Desuden kan den bruges til bestemmelse af kroppens specifikke varme; det vil sige den mængde varme, som et gram af stoffet har brug for at absorbere for at hæve temperaturen med en grad Celsius. .
Den kalorimetriske bombe
Det er en enhed, hvor den mængde varme, der afgives eller absorberes i en reaktion, der opstår ved konstant volumen, måles.
Reaktionen finder sted i en robust stålbeholder (pumpen), der nedsænkes i et stort volumen vand. Dette holder vandtemperaturændringerne små. Det antages derfor, at ændringerne forbundet med reaktionen måles ved konstant volumen og temperatur..
Ovenstående indikerer, at der ikke udføres arbejde, når en reaktion udføres i et bombe-kalorimeter.
Reaktionen starter med at levere strøm gennem kabler, der er forbundet til pumpen.
Det adiabatiske kalorimeter
Det er kendetegnet ved at have en isolerende struktur kaldet et skjold. Skjoldet er placeret omkring cellen, hvor varme og temperaturændringer opstår. Ligeledes er det tilsluttet et elektronisk system, der holder temperaturen meget tæt på celle for at undgå varmeoverførsel..
I et adiabatisk kalorimeter minimeres temperaturforskellen mellem kalorimeteret og dets omgivelser; samt minimere varmeoverføringskoefficienten og tiden til varmeveksling.
Dets dele består af følgende:
-Cellen (eller beholderen), integreret i et isoleringssystem, ved hjælp af hvilket den forsøger at undgå varmetab.
-Termometeret til måling af temperaturændringer.
-Et varmelegeme, tilsluttet en styrbar kilde til elektrisk spænding.
-Og skjoldet, der allerede er nævnt.
I denne type kalorimeter kan egenskaber som entropi, Debye-temperatur og tilstands-elektrontæthed bestemmes..
Isoperibol kalorimeter
Det er en enhed, hvor reaktionscellen og pumpen nedsænkes i en struktur kaldet en kappe. I dette tilfælde består den såkaldte jakke af vand, der holdes ved en konstant temperatur.
Celle- og pumpetemperaturer stiger, når varmen frigøres under forbrændingsprocessen; men temperaturen på vandkappen holdes ved en fast temperatur.
En mikroprocessor styrer temperaturen på cellen og kappen og foretager de nødvendige korrektioner for lækagevarmen, der skyldes forskellene mellem de to temperaturer..
Disse korrektioner anvendes kontinuerligt og med en endelig korrektion baseret på målinger før og efter testen..
Flow kalorimeter
Udviklet af Caliendar har den en enhed til at flytte en gas i en container med konstant hastighed. Ved at tilføje varme måles temperaturstigningen i væsken.
Strømningskalorimeteret er kendetegnet ved:
- En nøjagtig måling af hastigheden for konstant flow.
- Nøjagtig måling af mængden af varme, der tilføres væsken gennem et varmelegeme.
- En nøjagtig måling af temperaturstigningen i gassen forårsaget af energiindgang
- Et design til måling af gasens kapacitet under tryk.
Kalorimeteret til differentiel scanningskalorimetri
Det er kendetegnet ved at have to beholdere: i den ene placeres den prøve, der skal undersøges, mens den anden holdes tom, eller der anvendes et referencemateriale..
De to beholdere opvarmes med en konstant energihastighed ved hjælp af to uafhængige varmeapparater. Når de to kar begynder at varme op, plotter computeren forskellen i varmestrøm fra varmelegeme mod temperaturen, hvorved varmestrømmen kan bestemmes..
Desuden kan temperaturvariationen bestemmes som en funktion af tiden; og endelig kalorieevnen.
Ansøgninger
I fysisk-kemi
-De grundlæggende kalorimetre, type kaffekop, gør det muligt at måle den mængde varme, som en krop afgiver eller absorberer. I dem er det muligt at bestemme, om en reaktion er eksoterm eller endoterm. Derudover kan kroppens specifikke varme bestemmes.
-Med det adiabatiske kalorimeter har det været muligt at bestemme entropien af en kemisk proces og den elektroniske densitet af staten.
I biologiske systemer
-Mikrokalorimetre bruges til at studere biologiske systemer, der inkluderer interaktioner mellem molekyler såvel som de molekylære konformationsændringer, der opstår; for eksempel i udfoldelsen af et molekyle. Linjen inkluderer både differentiel fejning og isoterm titrering.
-Mikrokalorimeteret anvendes til udvikling af lægemidler med små molekyler, bioterapeutiske midler og vacciner.
Oxygen Pump Calorimeter og Caloric Power
I iltbombe kalorimeteret finder forbrændingen af adskillige stoffer sted, og dens kalorieværdi kan bestemmes. Blandt de stoffer, der er undersøgt ved hjælp af dette kalorimeter, er: kul og koks; spiselige olier, både tunge og lette; benzin og alle motorbrændstoffer.
Samt typer af brændstoffer til flyreaktorer; brændstofaffald og bortskaffelse af affald; fødevareprodukter og kosttilskud til ernæring til mennesker; foderafgrøder og kosttilskud til dyrefoder; Byggematerialer; raketbrændstoffer og drivmidler.
Ligeledes er kalorieeffekten bestemt ved kalorimetri i termodynamiske undersøgelser af brændbare materialer; i studiet af energibalance i økologi; i sprængstoffer og termiske pulvere og i undervisning i grundlæggende termodynamiske metoder.
Referencer
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Læring.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabatisk kalorimetri og dens anvendelser. Gendannet fra: cenam.mx
- Wikipedia. (2018). Kalorimeter. Gendannet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). Kalorimeterdefinition i kemi. Gendannet fra: thoughtco.com
- Gillespie, Claire. (11. april 2018). Hvordan fungerer et kalorimeter? Videnskabelig. Gendannet fra: sciencing.com



Endnu ingen kommentarer