
Kaliumcarbonat (K2CO3) struktur, egenskaber, anvendelser, produktion

Det Kaliumcarbonat er en uorganisk forbindelse dannet af to kalium K-ioner+ og en carbonation CO3to-. Dens kemiske formel er KtoCO3. Det er et hygroskopisk hvidt fast stof, det vil sige, det absorberer let vand fra miljøet. Af denne grund bruges det i laboratorier til at absorbere vand fra andre stoffer..
Det er meget opløseligt i vand og danner alkaliske opløsninger, der er rige på OH-ioner.-og derfor med en høj pH-værdi. Dens vandige opløsninger, som er basiske, anvendes i forskellige industrielle processer til at absorbere sure gasser såsom kuldioxid COto og hydrogensulfid HtoJa, det neutraliserer dem let.

KtoCO3 Det bruges til at forberede sæber, rengøringsprodukter, vaskemidler og opvaskemixer. Det bruges også til forarbejdning af nogle tekstilfibre som uld..
Det bruges i vid udstrækning i kemilaboratorier, for eksempel til at absorbere vand fra andre forbindelser eller til at alkalisere blandinger af kemiske reaktioner og også i kemisk analyse.
Det tilsættes også til nogle fødevarer, for eksempel for at fjerne den bitre smag af kakaobønner under produktionen af chokolade..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Densitet
- 3.6 Opløselighed
- 3,7 pH
- 3.8 Kemiske egenskaber
- 4 Opnåelse
- 5 anvendelser
- 5.1 I optagelsen af CO2 i industrielle processer
- 5.2 Ved fjernelse af H2S fra visse processer
- 5.3 I kemilaboratorier
- 5.4 I rengøringsmiddelindustrien
- 5.5 I fødevareindustrien
- 5.6 I gødning
- 5.7 I forskellige applikationer
- 6 Referencer
Struktur
Kaliumcarbonat består af to kalium K-kationer+ og en carbonatanion CO3to-. Carbonatanionen har en flad og symmetrisk struktur, mens de tre iltatomer omgiver kulstoffet og danner en flad trekant..
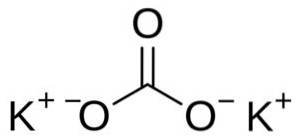
Nomenklatur
- Kaliumcarbonat
- Kaliumcarbonat
- Kaliumcarbonat
- Potash
- Kaliumsalt af kulsyre.
Ejendomme
Fysisk tilstand
Farveløst til hvidt krystallinsk fast stof.
Molekylær vægt
138,205 g / mol.
Smeltepunkt
899 ºC.
Kogepunkt
Det nedbrydes.
Massefylde
2,29 g / cm3
Opløselighed
Meget opløselig i vand: 111 g / 100 g vand ved 25 ° C. Uopløselig i ethanol og acetone.
pH
En vandig opløsning kan have en pH-værdi på 11,6, det vil sige, den er ret basisk.
Kemiske egenskaber
Kaliumcarbonat er deliquescent eller hygroskopisk, dvs. absorberer fugt fra miljøet. Det har et stabilt hydrat, KtoCO3.2HtoELLER.
KtoCO3 i vandig opløsning hydrolyserer den, det vil sige, den reagerer med vand, der frigiver OH-grupper- hvilke er dem, der giver opløsningerne alkalinitet:
CO3to- + HtoO ⇔ OH- + HCO3-
HCO3- + HtoO ⇔ OH- + HtoCO3
Opnåelse
Det kan fås fra asken, der er tilbage, når man brænder planter. Også ved karbonatisering af kaliumhydroxid KOH, dvs. tilsætning af overskydende kuldioxid COto til KOH:
KOH + COto → KHCO3
2 KHCO3 + varme → KtoCO3 + HtoELLER
En anden måde at opnå det på er ved opvarmning af kaliumchlorid KCl med magnesiumcarbonat MgCO3, vand og COto under pres. Et hydreret dobbelt salt af magnesium og kalium opnås først MgCO3.KHCO3.4HtoEller kaldet Engels salt:
2 KCl + 3 MgCO3 + COto + 5 timertoO → MgCO3.KHCO3.4HtoO ↓ + MgClto
Engels 'hydratiserede dobbeltsalt udfældes og filtreres ud af opløsningen. Derefter opvarmes det, og kaliumcarbonat K dannestoCO3 at ved tilsætning af vand opløses mens magnesiumcarbonat MgCO3 forbliver uopløselig og fjernes ved filtrering.
MgCO3.KHCO3.4HtoO + varme → MgCO3↓ + 2K+ + CO3to- + COto↑ + 9 HtoELLER
Ansøgninger
I absorptionen af COto i industrielle processer
Kaliumcarbonatopløsningen er den klassiske behandling til fjernelse af kuldioxid COto i forskellige processer, især i applikationer med højt tryk og høj temperatur.

Fjernelse af COto forekommer i henhold til følgende reaktion:
KtoCO3 + COto + HtoO ⇔ 2 KHCO3
Denne metode bruges f.eks. Til behandling af naturgas. Også i kraftværker for at undgå udledning af COto ind i atmosfæren og i produktionen af tøris.

K's løsningtoCO3 kan regenereres termisk, dvs. ved opvarmning til temperaturer omkring 100 ° C.
For at kaliumcarbonatopløsningen kan absorbere CO2 med en god hastighed, tilføjes promotorer, der fremskynder processen såsom diethanolamin (DEA)..
Ved fjernelse af HtoS for visse processer
Kaliumcarbonatopløsninger anvendes også til at fjerne hydrogensulfidgas HtoS for processtrømme. Kalium K-triphosphat tilsættes undertiden3PO4 for at gøre processen hurtigere.
I kemilaboratorier
KtoCO3 Det gør det muligt at udføre organiske synteser, for eksempel i kondensationsreaktioner og at neutralisere. Det bruges til at fjerne vand fra organiske væsker som et dehydratiseringsmiddel eller tørremiddel i laboratoriet.
Det bruges også til analytiske kemiske reaktioner og til alkalisering i den farmaceutiske industri..
I rengøringsmiddelindustrien
KtoCO3 Det bruges til at fremstille sæbe, rengøringsformler, vaske- og opvaskeprodukter og også til at forberede shampoo og andre produkter til personlig pleje.

I fødevareindustrien
Kaliumcarbonat tilsættes til forskellige fødevarer til forskellige formål.
For eksempel tilsættes det til kakaobønner for at fjerne deres bitre smag og bruge dem til produktion af chokolade. Det tilsættes druerne i tørringsprocessen for at opnå rosiner.

I wienerbrød bruges det som et hævemiddel (som fungerer som gær) til mel til forberedelse af bagværk..

I gødning
KtoCO3 Det bruges til at befrugte sure jordarter, da carbonationen CO3to- i kontakt med vand producerer OH-ioner- der øger jordens pH. Plus kalium K+ det er et næringsstof til planter.
Kaliumcarbonat er også blevet brugt til at fremstille gødning med langsom frigivelse.
En gødning med langsom frigivelse frigiver eller frigiver næringsstoffer langsomt, så de ikke opløses og vaskes væk. Takket være dette vil de være i stand til at bruge mere tid til rådighed for plantens rødder.
I forskellige applikationer
Kaliumcarbonat KtoCO3 det bruges også til at:
- Rå uldfarvning, blegning og rengøringsprocesser og andre aktiviteter inden for tekstilindustrien
- Opnåelse af andre organiske og uorganiske kaliumsalte, såsom KCN kaliumcyanid.
- Fungerer som surhedsregulator i forskellige processer.
- Fremstilling af keramik og keramik.
- Graverings- og litografiprocesser.
- Garvning og efterbehandling af læder.
- Forbered blæk til trykning, pigmenter.
- Fremstill briller specielt til tv, da KtoCO3 er mere kompatibel end natriumcarbonat NatoCO3 med bly, barium og strontiumoxider indeholdt i disse glas.
- Vandbehandling.
- Brandhæmmende (i form af vandige opløsninger).
- Hæmmer korrosion og som et antifouling middel i procesudstyr.
Referencer
- OS. National Library of Medicine. (2019). Kaliumcarbonat. Gendannet fra pubchem.ncbi.nlm.nih.gov.
- Steele, D. (1966). Metalliske elementers kemi. Pergamon Press Ltd. London.
- Mokhatab, S. et al. (2019). Naturlig gasbehandling. Kaliumcarbonatopløsningen. I håndbog om transmission og behandling af naturgas (fjerde udgave). Gendannet fra sciencedirect.com.
- Kakaras, E. et al. (2012). PFBC-kombinerede cyklusanlæg med fluidiseret leje. Forbrænding med fluidiseret leje under tryk med opsamling og lagring af kulstof. I kombinerede cyklussystemer til kraftgenerering med næsten nul emission. Gendannet fra sciencedirect.com.
- Speight, J.G. (2019). Brintproduktion. Våd skrubning. I opsving og opgradering af tung olie. Gendannet fra sciencedirect.com.
- Branan, C.R. (2005). Gasbehandling: Kapitel opdateret af Chris Higman. Processer med varmt karbonat. I Thumb Rules for Chemical Engineers (fjerde udgave). Gendannet fra sciencedirect.com.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde udgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte udgave. VCH Verlagsgesellschaft mbH.
- Li, Y. og Cheng, F. (2016). Syntese af en roman med langsom frigivelse af kaliumgødning fra modificeret Pidgeon-magnesiumslagge med kaliumcarbonat. J Air Waste Manag Assoc, 2016 aug; 66 (8): 758-67. Gendannet fra ncbi.nlm.nih.gov.



Endnu ingen kommentarer