
Komponenter i elektrokemiske celler, hvordan de fungerer, typer, eksempel
Det elektrokemiske celler De er enheder, hvor kemiske reaktioner finder sted, hvor kemisk energi omdannes til elektrisk energi eller omvendt. Disse celler udgør hjertet af elektrokemi, hvor sjælen er den potentielle udveksling af elektroner, der kan forekomme, spontant eller ej, mellem to kemiske arter..
En af de to arter oxiderer, mister elektroner, mens den anden reduceres og vinder de overførte elektroner. Almindeligvis er arten, der reduceres, en metallisk kation i opløsning, som ved at vinde elektroner ender med at blive aflejret elektrisk på en elektrode lavet af det samme metal. På den anden side er arten, der oxiderer, et metal, der bliver til metalkationer.
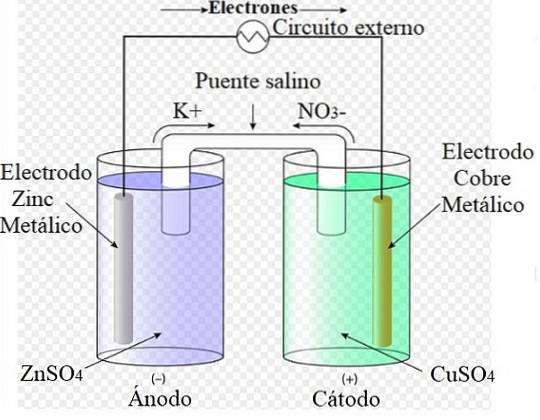
For eksempel repræsenterer billedet ovenfor Daniels celle: den enkleste af alle elektrokemiske celler. Den metalliske zinkelektrode oxiderer og frigiver Zn-kationerto+ til det vandige medium. Dette sker i ZnSO-containeren4 til venstre.
Til højre løsningen indeholdende CuSO4 reduceres og transformerer kationerne Cuto+ i metallisk kobber, der aflejres på kobberelektroden. Under udviklingen af denne reaktion bevæger elektronerne sig gennem et eksternt kredsløb, der aktiverer dets mekanismer; og derfor tilvejebringelse af elektrisk energi til driften af et team.
Artikelindeks
- 1 Komponenter i elektrokemiske celler
- 1.1 Elektroder
- 1.2 Opløsning af elektrolytter
- 1.3 Saltbro
- 2 Typer elektrokemiske celler og hvordan de fungerer
- 2.1 Galvanisk
- 2.2 Elektrolytika
- 3 eksempler
- 3.1 Daniels celle
- 3.2 Platin og brintcelle
- 3.3 Nedadgående celle
- 4 Referencer
Elektrokemiske cellekomponenter
Elektroder
Elektriske strømme genereres eller forbruges i elektrokemiske celler. For at sikre en tilstrækkelig strøm af elektroner skal der være materialer, der er gode ledere af elektricitet. Det er her elektroderne og det eksterne kredsløb kommer ind, forsynet med kobber, sølv eller guld ledninger..
Elektroderne er de materialer, der danner overfladen, hvor reaktionerne vil finde sted i de elektrokemiske celler. Der er to typer i henhold til reaktionen, der forekommer i dem:
-Anode, elektrode hvor oxidation opstår
-Katode, elektrode hvor reduktion opstår
Elektroderne kan være lavet af et reagerende materiale, som det er tilfældet med Daniels celle (zink og kobber); eller et inaktivt materiale, såsom når de er fremstillet af platin eller grafit.
Elektronerne frigivet af anoden skal nå katoden; men ikke gennem en løsning, men gennem et metallisk kabel, der forbinder begge elektroder til et eksternt kredsløb.
Elektrolytopløsning
Løsningen, der omgiver elektroderne, spiller også en vigtig rolle, da den er beriget med stærke elektrolytter; såsom: KCl, KNO3, NaCl osv. Disse ioner favoriserer til en vis grad migrering af elektroner fra anoden til katoden såvel som deres ledning gennem elektroderne i nærheden af at interagere med den art, der skal reduceres..
Havvand leder for eksempel elektricitet meget bedre end destilleret vand med en lavere ionkoncentration. Derfor har elektrokemiske celler en opløsning af stærke elektrolytter blandt deres komponenter..
Saltvand bro
Ionerne i opløsningen begynder at omgive elektroderne, hvilket forårsager en polarisering af ladningerne. Løsningen omkring katoden begynder at blive negativt ladet, da kationerne reduceres; i tilfælde af Daniels celle, Cu-kationerneto+ ved at deponere som metallisk kobber på katoden. Således begynder der at være et underskud på positive afgifter.
Det er her saltbroen griber ind for at afbalancere ladningerne og forhindre, at elektroderne polariserer. Mod siden eller rummet af katoden vil kationer migrere fra saltbroen, enten K+ eller Znto+, at erstatte Cuto+ forbrugt. I mellemtiden migrerer INGEN anioner fra saltbroen3- mod anodeafdelingen for at neutralisere den stigende koncentration af Zn-kationerto+.
Saltbroen består af en mættet opløsning af salte med enderne dækket af en gel, der er permeabel for ioner, men uigennemtrængelig for vand..
Elektrokemiske celletyper og hvordan de fungerer
Hvordan en elektrokemisk celle fungerer afhænger af hvilken type den er. Der er grundlæggende to typer: galvanisk (eller voltaisk) og elektrolytisk.
Galvanisk
Daniels celle er et eksempel på en galvanisk elektrokemisk celle. I dem forekommer reaktionerne spontant, og batteriets potentiale er positivt; jo højere potentiale, jo mere elektricitet vil cellen levere.
Celler eller batterier er nøjagtigt galvaniske celler: det kemiske potentiale mellem de to elektroder omdannes til elektrisk energi, når et eksternt kredsløb griber ind, der forbinder dem. Således migrerer elektronerne fra anoden, antænder det udstyr, som batteriet er tilsluttet, og returneres direkte til katoden.
Elektrolytisk
Elektrolytiske celler er dem, hvis reaktioner ikke sker spontant, medmindre de forsynes med elektrisk energi fra en ekstern kilde. Her forekommer det modsatte fænomen: elektricitet tillader ikke-spontane kemiske reaktioner at udvikle sig.
En af de mest kendte og mest værdifulde reaktioner, der finder sted inden for denne type celler, er elektrolyse..
Genopladelige batterier er eksempler på elektrolytiske og samtidig galvaniske celler: de genoplades for at vende deres kemiske reaktioner og genoprette de oprindelige betingelser, der skal genbruges..
Eksempler
Daniels celle
Den følgende kemiske ligning svarer til reaktionen i Daniels celle, hvor zink og kobber deltager:
Zn (s) + Cuto+(aq) → Znto+(aq) + Cu (s)
Men Cu-kationerneto+ og Znto+ de er ikke alene, men ledsaget af anionerne SÅ4to-. Denne celle kan repræsenteres som følger:
Zn | ZnSO4 | | RUTE4 | Cu
Daniels celle kan bygges i ethvert laboratorium, idet den er meget tilbagevendende som en praksis i introduktionen af elektrokemi. Som Cuto+ deponeres som Cu, den blå farve af CuSO-opløsningen4 vil gå tabt.
Platinbrintcelle
Forestil dig en celle, der bruger brintgas, producerer metallisk sølv og samtidig leverer elektricitet. Dette er platin- og hydrogencellen, og dens generelle reaktion er som følger:
2AgCl (s) + Hto(g) → 2Ag (s) + 2H+ + 2Cl-
Her i anodeafdelingen har vi en inert platinelektrode, nedsænket i vand, og hvori hydrogengas pumpes. Hto oxideres til H+ og giver dets elektroner til det mælkeagtige AgCl-bundfald i katodeafdelingen med en metallisk sølvelektrode. På dette sølv reduceres AgCl, og elektrodenes masse øges..
Denne celle kan repræsenteres som:
Pt, Hto | H+ | | Cl-, AgCl | Ag
Nedadgående celle
Og endelig har vi blandt de elektrolytiske celler den smeltede natriumchloridcelle, bedre kendt som Downs-cellen. Her bruges elektricitet, så et volumen smeltet NaCl passerer gennem elektroderne, hvilket forårsager følgende reaktioner i dem:
2Na+(l) + 2e- → 2Na (s) (katode)
2Cl-(l) → Clto(g) + 2e- (anode)
2NaCl (l) → 2Na (s) + Clto(g) (global reaktion)
Takket være elektricitet og natriumchlorid kan der således fremstilles metallisk natrium og klorgas..
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2020). Elektrokemisk celle. Gendannet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (29. januar 2020). Elektrokemiske celler. Gendannet fra: thoughtco.com
- R. Skib. (s.f.). Elektrokemiske celler. Gendannet fra: hyperphysics.phy-astr.gsu.edu
- Chemicool. (2017). Definition af elektrokemisk celle. Gendannet fra: chemicool.com
- Patricia Jankowski. (2020). Hvad er en elektrokemisk celle? - Struktur og anvendelser. Undersøgelse. Gendannet fra: study.com
- Alkemi (3. marts 2011). Elektrokemiske celler. Kemi og videnskab. Gendannet fra: laquimicaylaciencia.blogspot.com



Endnu ingen kommentarer