
Cyclopropan (C3H6) Struktur, egenskaber, anvendelser og risici

Det cyclopropan er et cyklisk molekyle, der har molekylformlen C3H6, og bestående af tre carbonatomer bundet sammen i form af en ring. I kemien er der en familie af mættede kulbrinter, der har et skelet, der består af carbonatomer, der er forbundet med enkeltbindinger i form af en ring..
Denne familie består af et varieret antal molekyler (som adskiller sig ved længden af deres vigtigste carbonkæde) og er kendt for at have højere smelte- og kogepunkter end de for høje kæder samt en større reaktivitet end disse..
Cyclopropan blev opdaget i 1881 af en østrigsk kemiker ved navn August Freund, som var fast besluttet på at vide, hvad der var det giftige element i ethylen, og som kom til at tro, at det var den samme cyclopropan.
Alligevel var det først i 1930'erne, at det begyndte at blive produceret på industrielt niveau, da de opdagede dets anvendelser som anæstesi, for før den tid fandt de det ikke kommercielt attraktivt..
Artikelindeks
- 1 Kemisk struktur
- 2 egenskaber
- 2.1 Kogepunkt
- 2.2 Smeltepunkt
- 2.3 Densitet
- 2.4 Reaktivitet
- 3 anvendelser
- 4 risici
- 5 Referencer
Kemisk struktur
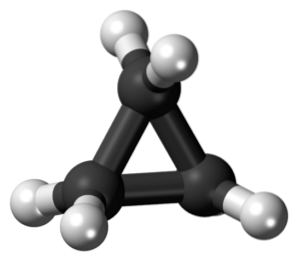
Cyclopropan med molekylformel C3H6, Den består af tre små kulstofatomer, der sammenføjes i en sådan konfiguration, at der dannes en ring, der efterlader en molekylær symmetri af D3 timer på hvert kulstof i kæden.
Strukturen af dette molekyle kræver, at bindingsvinklerne, der dannes, er ca. 60 °, meget mindre end de 109,5 °, der observeres mellem sp-hybridatomer.3, hvilket er en mere termodynamisk stabil vinkel.
Dette fører til, at ringen lider af en mere signifikant strukturel spænding end andre strukturer af denne type, ud over en naturlig torsionsspænding, som den besidder på grund af den formørkede konformation af dens hydrogenatomer..
Af samme grund er bindingerne, der dannes mellem kulstofatomer i dette molekyle, betydeligt svagere end i almindelige alkaner..
På en ejendommelig måde og i modsætning til andre bindinger, hvor nærheden mellem to molekyler symboliserer større bindingsenergi, har bindingerne mellem kulstofferne i dette molekyle en specificitet af at have en kortere længde end de andre alkaner (på grund af deres geometri) og på samme måde når de er svagere end fagforeningerne mellem disse.
Desuden besidder cyclopropan stabiliteten ved cyklisk delokalisering af de seks elektroner i carbon-carbonbindingerne, idet de er lidt mere ustabil end cyclobutan og betydeligt mere end cyclohexan..
Ejendomme
Kogepunkt
Sammenlignet med de andre mere almindelige cycloalkaner har cyclopropan det laveste kogepunkt blandt disse typer af molekyler, der voltatiserer ved 33 grader under nul (ingen andre cycloalkaner flygtiggør ved temperaturer under nul).
På den anden side sammenlignet med lineær propan har cyclopropan et højere kogepunkt: det flygtiggøres ved 42 ° C under nul, lidt lavere end dets cycloalkan fætter.
Smeltepunkt
Smeltepunktet for cyclopropan er lavere end for andre cycloalkaner og smelter ved en temperatur på 128 ºC lavere end nul. Alligevel er det ikke den eneste cycloalkan, der smelter ved en temperatur under nul, og dette fænomen kan også observeres i cyclobutan, cyclopentan og cycloheptan..
Så i tilfælde af lineær propan smelter den ved en temperatur lavere end 187 ° C under nul..
Massefylde
Cyclopropan har den højeste tæthed blandt cycloalkaner og er mere end to gange højere end den tætteste almindelige cycloalkan (1.879 g / l for cyclopropan, der overgår cyclodecan med 0.871).
En højere densitet observeres også i cyclopropan end i lineær propan. Forskellen i kogepunkter og smeltepunkter mellem lineære alkaner og cycloalkaner skyldes højere London-kræfter, som øges af ringformen, der tillader et større kontaktareal mellem indre atomer..
Reaktivitet
Reaktiviteten af cyclopropanmolekylet påvirkes direkte af svagheden af dets bindinger, hvilket øges betydeligt sammenlignet med andre cycloalkaner på grund af effekten af den spænding, der udøves på disse bindinger..
Takket være dette kan cyclopropan separeres lettere og kan opføre sig som en alken i visse reaktioner. Faktisk kan den ekstreme reaktivitet af cyclopropan-iltblandinger blive en eksplosionsfare..
Ansøgninger
Den kommercielle anvendelse af cyclopropan par excellence er som et bedøvelsesmiddel, der studerer denne egenskab for første gang i 1929.
Cyclopropan er et kraftigt, hurtigtvirkende bedøvelsesmiddel, der ikke irriterer luftvejene eller har en dårlig lugt. Det blev brugt i flere årtier sammen med ilt til at sætte patienter i søvn under operationen, men uønskede bivirkninger begyndte at blive observeret, repræsenteret som "cyclopropanchok.".
Sammen med omkostningerne og de høje antændelsesfaktorer gennemgik det en proces med kassering og udskiftning med andre sikrere bedøvelsesmidler..
Selv om det fortsat var en del af de forbindelser, der blev brugt til induktion af anæstesi, er det i dag ikke en del af de midler, der anvendes i medicinske applikationer.
Risici
- Cyclopropan er en meget brandfarlig gas, der producerer giftige gasser, når den kommer i kontakt med en flamme. Derudover kan det reagere med oxidationsmidler såsom perchlorater, peroxider, permanganater, nitrater og halogener, hvilket forårsager brande og / eller eksplosioner..
- Høje niveauer af cyclopropan kan forårsage hovedpine, svimmelhed, kvalme, koordinationstab, svimmelhed og / eller lyshår..
- Det kan også føre til uregelmæssigheder i hjerterytmen eller arytmi, åndedrætsbesvær, koma og endda døden..
- Den flydende cyclopropan kan forårsage forfrysninger på huden på grund af dens temperatur betydeligt under nul.
- Fordi det er en gas under omgivende forhold, kan denne forbindelse let komme ind i kroppen gennem luften, og det reducerer også niveauet af ilt i luften..
Referencer
- Britannica, E. (s.f.). Cyclopropan. Hentet fra britannica.com
- Chemistry, O. (s.f.). Cyclopropansyntese. Gendannet fra organisk-kemi.org
- ChemSpider. (s.f.). Cyclopropan. Hentet fra chemspider.com
- Wagnières, O. (s.f.). Cyclopropanholdige naturlige produkter. Gendannet fra lspn.epfl.ch
- Wikipedia. (s.f.). Cyclopropan. Hentet fra en.wikipedia.org
Endnu ingen kommentarer