
Hypoiodinsyre (HIO) formel, egenskaber og anvendelser

Det hypojodsyre, også kendt som hydrogenmonoxoiodat (I) eller iodol, er det en uorganisk forbindelse med formlen HIO. Det er en oxacid af jod med et oxygenatom, et hydrogenatom og et jodatom med en oxidationstilstand på 1+.
Forbindelsen er meget ustabil, da den har en tendens til at gennemgå en dismutationsreaktion, hvor den reduceres til molekylært iod og oxideres til iodsyre ifølge reaktionen: 5HIO → 2Ito + HIO3 + 2HtoELLER.
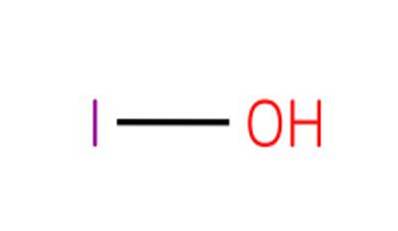
Forbindelsen er den svageste syre i 1+ oxidationstilstanden halogenoxidsyrer. De tilsvarende salte af denne syre er kendt som hypoioditter.
Disse salte er mere stabile end syre og dannes på samme måde som deres chlor- og brom-modstykker ved at reagere molekylært iod med alkali- eller jordalkalimetalhydroxider..
Hypojodsyre produceres ved at reagere molekylært jod med kviksølv (II) oxid (Egon Wiberg, 2001) ifølge reaktionen:
2Ito + 3HgO + HtoO → 2HIO + HgIto ● 2HgO
Spor af forbindelsen opnås også ved omsætning af molekylært iod med kaliumhydroxid til dannelse, indledningsvis kaliumiodid og kaliumhypoiodit ifølge reaktionen:
jegto + 2KOH → KI + KIO
Imidlertid gør hypoiodinsyre, som er en så svag syre, hydrolysering af kaliumhypoiodit mulig, medmindre der er overskydende kaliumhydroxid (Holmyard, 1922).
KIO + HtoO → HIO + KOH
Det kan også fås, ligesom dets modstykker med klor og brom, ved at reagere molekylært iod med vand. Men i betragtning af dens lave ligevægtskonstant, som er i størrelsesordenen 10-13, de opnåede mængder er meget små (R.G. Compton, 1972).
Artikelindeks
- 1 Fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber
Hypoiodinsyre eksisterer kun som en vandig opløsning, der har en gullig farve. Forbindelsen i fast tilstand er ikke blevet isoleret, så de fleste af dens egenskaber opnås teoretisk ved beregningsberegninger (National Center for Biotechnology Information, 2017).
Hypoiodinsyre har en molekylvægt på 143,911 g / mol, et smeltepunkt på 219,81 ° C, et kogepunkt på 544,27 ° C og et damptryk på 6,73 x 10-14 millimeter kviksølv.
Molekylet er meget opløseligt i vand og kan opløses mellem 5,35 x 105 og 8,54 x 105 gram forbindelse pr. liter af dette opløsningsmiddel (Royal Society of Chemistry, 2015).
HOI er en stærk oxidant og kan danne eksplosive blandinger. Det er også et reduktionsmiddel og kan oxideres til iod-, iod- og periodiske former af syren. I vandige opløsninger, der er en svag syre, adskiller den sig delvist i hypoioditionen (OI-) og H+.
HOI reagerer med baser for at danne salte kaldet hypoioditter. F.eks. Dannes natriumhypoiodit (NaOI) ved omsætning af hypoiodinsyre med natriumhydroxid..
HOI + NaOH → NaOI + HtoELLER
Hypoiodinsyre reagerer også let med en række organiske molekyler og biomolekyler..
Reaktivitet og farer
Hypoiodinsyre er en ustabil forbindelse, der nedbrydes til elementært iod. Jod er en giftig forbindelse, der skal håndteres med forsigtighed.
Hypoiodinsyre er farlig i tilfælde af hudkontakt (irriterende), i kontakt med øjnene (irriterende) og i tilfælde af indtagelse og indånding.
I tilfælde af kontakt med øjnene skal du kontrollere, om du har kontaktlinser, og fjerne dem med det samme. Øjne skal skylles med rindende vand i mindst 15 minutter, så øjenlågene holdes åbne. Koldt vand kan bruges. Øjen salve bør ikke bruges.
Hvis kemikaliet kommer i kontakt med tøj, skal du fjerne det så hurtigt som muligt og beskytte dine egne hænder og krop. Anbring offeret under et sikkerhedsbrusebad.
Hvis kemikaliet akkumuleres på offerets udsatte hud, såsom hænder, vaskes den forurenede hud forsigtigt og omhyggeligt med rindende vand og ikke-slibende sæbe. Koldt vand kan bruges. Søg lægehjælp, hvis irritationen vedvarer. Vask det forurenede tøj, inden det bruges igen.
Hvis hudkontakten er svær, skal den vaskes med et desinfektionsmiddel og sæbe og dække den forurenede hud med en antibakteriel creme..
I tilfælde af indånding skal offeret få lov til at hvile i et godt ventileret område. Hvis inhalationen er svær, skal offeret evakueres til et sikkert område hurtigst muligt. Løsn stramt tøj såsom en skjortekrave, bælte eller slips.
Hvis offeret har svært ved at trække vejret, skal der gives ilt. Hvis offeret ikke trækker vejret, udføres genoplivning fra mund til mund. Husk altid, at det kan være farligt for den person, der yder hjælp til at give genoplivning fra mund til mund, når det indåndede materiale er giftigt, smitsomt eller ætsende..
Fremkald ikke opkastning ved indtagelse. Løsn stramt tøj såsom skjortekraver, bælter eller bånd. Hvis offeret ikke trækker vejret, skal du udføre genoplivning fra mund til mund.
I alle tilfælde skal du straks søge lægehjælp..
Ansøgninger
Hypoiodinsyre bruges som et stærkt oxidationsmiddel og som et reduktionsmiddel i laboratoriereaktioner. Det bruges til at producere kemiske forbindelser kendt som hypoioditter..
Spektrofotometriske metoder anvendes også til at måle dannelsen af hypoiodinsyre til overvågning af reaktioner, hvor iod er involveret (T. L. Allen, 1955).
Halogenider inkorporeres i aerosoler, hvor de begynder den katalytiske destruktion af ozon (O3) over havene og påvirke den globale troposfære. To spændende miljøproblemer under igangværende forskning er: at forstå, hvordan molekylære halogener i den reaktive gasfase produceres direkte fra uorganiske halogenider udsat for O3 og begrænse de miljøfaktorer, der styrer denne grænsefladeproces.
I arbejdet med (Elizabeth A. Pillar, 2013) blev omdannelsen af iodid til hypoiodinsyre ved ozons virkning målt gennem massespektroskopimålinger for at bestemme en model for ozonnedbrydning i atmosfæren..
Referencer
- Egon Wiberg, N. W. (2001). Uorganisk kemi. London: Akademisk presse.
- Elizabeth A. Pillar, M. I. (2013). Omdannelse af jod til hypojodsyre og jod i vandige mikrodråber udsat for ozon. Sci. Technol., 47 (19), 10971-10979.
- EMBL-EBI. (2008, 5. januar). hypojodsyre. Hentet fra ChEBI: ebi.ac.uk.
- Holmyard, E. (1922). Uorganisk kemi. London: Edwar Arnol & co.
- National Center for Biotechnology Information ... (2017, 22. april). PubChem Compound Database; CID = 123340. Hentet fra PubChem.
- G. Compton, C. B. (1972). Reaktioner af ikke-metalliske uorganiske forbindelser. Ansterdam: Elsevier Publishing Company.
- Royal Society of Chemistry. (2015). Iodol. Hentet fra chemspider.com.
- L. Allen, R. M. (1955). Dannelsen af hypojodsyre og hydreret jodkation ved hydrolyse af jod. J. Am. Chem. Soc., 77 (11) , 2957-2960.

Endnu ingen kommentarer