
Manganchlorid egenskaber, struktur, anvendelser, risici

Det manganchlorid er et uorganisk salt, hvis kemiske formel er MnClto. Den består af Mn-ionerto+ og Cl- i forholdet 1: 2; for hver Mn-kationto+ der er dobbelt så mange anioner Cl-.
Dette salt kan danne forskellige hydrater: MnClto2HtoO, (dihydrat), MnClto4HtoO (tetrahydrat) og MnClto6HtoO (hexahydrat) Den mest almindelige form for salt er tetrahydrat.

De fysiske egenskaber af manganchlorid såsom densitet, smeltepunkt og opløselighed i vand påvirkes af dets hydratiseringsgrad. For eksempel er smeltepunktet for den vandfri form meget højere end tetrahydratformens..
Farven på manganklorid er lyserød (øverste billede). Bleghed er karakteristisk for overgangsmetalsalte. Manganchlorid er en svag Lewis-syre.
Mineralet kendt som escacquita er den naturligt vandfri form af mangan (II) chlorid; ligesom kempita.
Mangan (II) chlorid anvendes som legeringsmiddel; katalysator i kloreringsreaktioner osv..
Artikelindeks
- 1 Fysiske egenskaber
- 1.1 Fysisk udseende
- 1.2 Molmasser
- 1.3 Smeltepunkter
- 1.4 Kogepunkt
- 1.5 Massefylde
- 1.6 Opløselighed i vand
- 1.7 Opløselighed i organiske opløsningsmidler
- 1.8 Nedbrydning
- 1,9 pH
- 1.10 Stabilitet
- 2 Struktur af manganchlorid
- 2.1 Dihydrat
- 2.2 Vandfri
- 3 Nomenklatur
- 4 anvendelser
- 4.1 Laboratorium
- 4.2 Industri
- 4.3 Gødning og dyrefoder
- 5 risici
- 6 Referencer
Fysiske egenskaber
Fysisk fremtoning
- Vandfri form: lyserøde kubiske krystaller.
- Tetrahydratform: let deliquescent rødlige monokliniske krystaller.
Molære masser
- Vandfri: 125,838 g / mol.
- Dihydrat: 161,874 g / mol.
- Tetrahydrat: 197,91 g / mol.
Smeltepunkter
- Vandfri: 654 ºC.
- Dihydrat: 135 ºC.
- Tetrahydrat: 58 ºC.
Kogepunkt
Vandfri form: 1.190 ºC.
Tætheder
- Vandfri: 2.977 g / cm3.
- Dihydrat: 2,27 g / cm3.
- Tetrahydrat: 2,01 g / cm33.
Vandopløselighed
Vandfri form: 63,4 g / 100 ml ved 0 ° C; 73,9 g / 100 ml ved 20 ° C; 88,5 g / 100 ml ved 40 ° C; og 123,8 g / 100 ml ved 100 ° C.
Opløselighed i organiske opløsningsmidler
Opløselig i pyridin og ethanol, uopløselig i ether.
Nedbrydning
Medmindre der træffes passende forholdsregler, kan dehydrering af de hydratiserede former til den vandfri form føre til hydrolytisk dehydrering med produktion af hydrogenchlorid og manganoxychlorid..
pH
En 0,2 M opløsning af manganchloridtetrahydrat i vandig opløsning har en pH-værdi på 5,5.
Stabilitet
Den er stabil, men følsom over for fugt og er uforenelig med stærke syrer, reaktive metaller og hydrogenperoxid.
Struktur af manganchlorid

Startende med det tetrahydrerede salt med slående lyserøde krystaller skal det bestå af koordinationskomplekser (øverste billede). I dem er det metalliske centrum af Mnto+ er omgivet af en oktaeder defineret af fire molekyler af HtoO og to Cl-anioner-.
Bemærk, at Cl-liganderne- er i cis-positioner; alle er ækvivalente i oktaederens rektangulære base, og det betyder ikke noget, om Cl'en "flyttes"- til en af de andre tre positioner. En anden mulig isomer for dette koordinatmolekyle er hvor begge Cl- er i transpositioner; det vil sige i forskellige ekstremer (den ene over og den anden nedenfor).
De fire vandmolekyler med deres hydrogenbindinger gør det muligt for to eller flere octahedra at blive forbundet med dipol-dipolkræfter. Disse broer er meget retningsbestemte og tilføjer de elektrostatiske interaktioner mellem Mnto+ og Cl-, etablere en ordnet struktur, der er karakteristisk for en krystal.
Den lyserøde farve af MnClto4HtoEller skyldes det de elektroniske overgange af Mnto+ og dens konfiguration d5. Ligeledes ændrer forstyrrelser forårsaget af nærhed af vandmolekyler og chlorider den mængde energi, der kræves for at blive absorberet af sådanne elektroner d5 at rejse højere energiniveauer.
Dihydrat
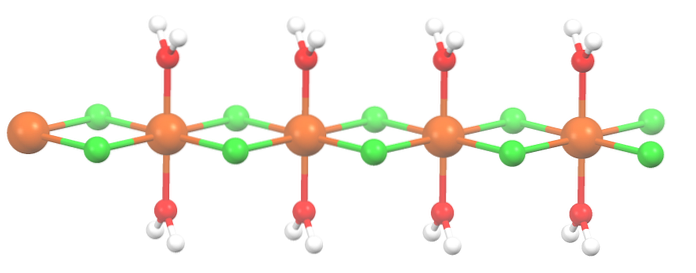
Saltet er blevet dehydreret, og dets formel er nu MnClto2HtoO. Hvad med oktaederne ovenfor? Intet, bortset fra at de to molekyler af HtoEller det, der droppede ud, erstattes af to Cl-.
Først kan du give det forkerte indtryk af, at der er fire Cl- for hver Mnto+; imidlertid er halvdelen af oktaederne (aksialt) faktisk den gentagne enhed af krystallen.
Således er det rigtigt, at der er en Mnto+ koordineret til to Cl- og to vandmolekyler i transpositioner. Men for at denne enhed kan interagere med en anden, har den brug for to Cl-broer, hvilket igen muliggør koordinering af oktaedron for mangan..
Ud over Cl-broer samarbejder vandmolekyler også med deres hydrogenbindinger, så denne MnCl-kædeto2HtoEller afvæbne ikke.
Vandfri
Endelig er magnesiumchloridet færdigt med at miste alt vand indeholdt i dets krystaller; vi har nu det vandfrie salt, MnClto. Uden vandmolekylerne mister krystallerne mærkbart intensiteten af deres lyserøde farve. Oktaheder, som for hydrater, forbliver uændret af selve naturen af mangan.
Uden vandmolekyler, Mnto+ ender omgivet af en oktaeder kun sammensat af Cl-. Denne koordinationsbinding har både kovalent og ionisk karakter; af denne grund henviser det normalt til strukturen af MnClto som en polymer krystal. I den er der alternative lag af Mn og Cl.
Nomenklatur
Mangan har mange mulige oxidationstilstande. På grund af dette er den traditionelle nomenklatur for MnClto det er ikke afklaret.
På den anden side svarer manganchlorid til dets bedre kendte navn, hvortil det ville være nødvendigt at tilføje '(II)' for at få det til at stemme overens med stamnomenklaturen: mangan (II) chlorid. Og ligeledes er der den systematiske nomenklatur: mangandichlorid.
Ansøgninger
Laboratorium
Manganchlorid fungerer som en katalysator til chlorering af organiske forbindelser.
Industri
Manganchlorid bruges som råmateriale til fremstilling af antiknopper til benzin; svejsning af ikke-jernholdige metaller; formidler til fremstilling af pigmenter; og tørretumbler til linolie.
Det bruges i tekstilindustrien til trykning og farvning; ved fremstilling af forskellige mangansalte, herunder methylcyclopentadienylmangan-tricarbonyl anvendt som murstenfarvestof; og i produktionen af tørre elektriske celler.
Manganchlorid anvendes som legeringsmiddel og tilsættes til smeltet magnesium for at fremstille mangan-magnesiumlegeringer; som et mellemprodukt ved fremstilling af tørringsmidler til maling og lak; og som en komponent i desinfektionsmidler.
Det bruges også til oprensning af magnesium.
Gødning og dyrefoder
Manganchlorid bruges som kilde til mangan, et element, der, selvom det ikke er et primært ernæringselement for planter som nitrogen, fosfor og kalium, bruges i adskillige biokemiske reaktioner, der er typiske for disse levende væsener.
Ligeledes føjes det til foderet til avlsdyr for at levere mangan, et vigtigt sporstof til dyrs vækst..
Manganchlorid er en diætkomponent, der leverer mangan, et element, der er involveret i mange processer, der er nødvendige for livet, herunder: syntese af fedtsyrer og kønshormoner; assimilering af E-vitamin; brusk produktion; etc.
Risici
Det kan forårsage rødme, irritation og dermatitis ved kontakt med huden. Manganchlorid forårsager røde, ømme og vandige øjne.
Ved indånding forårsager salt hoste, ondt i halsen og åndenød. På den anden side kan indtagelse forårsage opkastning, kvalme og diarré..
Kronisk overdreven inhalation af dette salt kan føre til lungebetændelse og efterfølgende reaktiv luftvejssygdom..
Dens overdreven indtagelse kan forårsage psykiske lidelser, dehydrering, hypotension, lever- og nyresvigt, svigt i multiorgan-systemet og død..
Neurotoksicitet er den indledende manifestation af manganens uønskede virkning og kan medføre hovedpine, svimmelhed, hukommelsestab, hyperrefleksi og mild tremor..
Alvorlig toksicitet manifesteres af symptomer og tegn, der ligner dem, der ses i Parkinsons sygdom.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Mangan (II) chlorid. Gendannet fra: en.wikipedia.org
- Sky Spring Nanomaterials. (2016). Manganskloridpulver. Gendannet fra: ssnano.com
- Kemikaliebog. (2017). Manganchlorid. Gendannet fra: chemicalbook.com
- Toksikologisk datanetværk. (s.f.). Manganchlorid. Toxnet. Gendannet fra: toxnet.nlm.nih.gov
- Gérard Cahiez. (2001). Mangan (II) chlorid. doi.org/10.1002/047084289X.rm020
- National Center for Biotechnology Information. (2019). Mangandichlorid. PubChem-database. CID = 24480. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- WebConsultas Healthcare, S.A. (2019). Mineraler: mangan. Gendannet fra: webconsultas.com



Endnu ingen kommentarer