
Kemisk koncentrationsekspression, enheder, molalitet

Det kemisk koncentration er det numeriske mål for den relative mængde opløst stof i en opløsning. Dette mål udtrykker et forhold mellem opløst stof og en mængde eller volumen af opløsningsmidlet eller opløsningen i koncentrationsenheder. Udtrykket "koncentration" er relateret til den tilstedeværende mængde opløst stof: en opløsning vil være mere koncentreret, jo mere opløselig den har.
Disse enheder kan være fysiske, når massen og / eller volumenstørrelsen af opløsningen eller kemiske komponenter tages i betragtning, når koncentrationen af det opløste stof udtrykkes i form af dets mol eller ækvivalenter, idet Avogadros nummer tages som reference..

Ved at bruge molekyl- eller atomvægte og Avogadros antal er det således muligt at konvertere fysiske enheder til kemiske enheder, når man udtrykker koncentrationen af en given opløsningsmiddel. Derfor kan alle enheder konverteres til den samme løsning.
Artikelindeks
- 1 Fortyndede og koncentrerede opløsninger
- 2 måder at udtrykke koncentration på
- 2.1 Kvalitativ beskrivelse
- 2.2 Klassificering efter opløselighed
- 2.3 Kvantitativ notation
- 3 koncentrationsenheder
- 3.1 Relative koncentrationsenheder
- 3.2 Enheder med fortyndet koncentration
- 3.3 Koncentrationsenheder som funktion af mol
- 3.4 Formalitet og normalitet
- 4 Molaritet
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 5 Normalitet
- 5.1 Beregning
- 5.2 Øvelse 1
- 6 Molalitet
- 6.1 Øvelse 1
- 7 Vigtige bemærkninger og anbefalinger om kemisk koncentration
- 7.1 Opløsningens volumen er altid større end opløsningsmidlets
- 7.2 Anvendelse af molaritet
- 7.3 Formler huskes ikke, men enheder eller definitioner er det
- 8 Referencer
Fortyndede og koncentrerede opløsninger
Hvordan kan du se, om en koncentration er meget fortyndet eller koncentreret? Ved første øjekast ved manifestationen af nogen af dens organoleptiske eller kemiske egenskaber; det vil sige dem, som sanserne opfatter, eller som kan måles.
Billedet ovenfor viser en fortynding af en koncentration af kaliumdichromat (KtoCrtoELLER7), som har en orange farve. Fra venstre mod højre kan du se, hvordan farven mindsker dens intensitet, når koncentrationen fortyndes, og tilsæt mere opløsningsmiddel.
Denne fortynding gør det muligt at opnå på denne måde en fortyndet koncentration fra en koncentreret. Farven (og andre "skjulte" egenskaber i sin orange kerne) ændres på samme måde som dens koncentration gør, enten med fysiske eller kemiske enheder..
Men hvad er de kemiske koncentrationsenheder? Blandt dem er molariteten eller molkoncentrationen af en opløsning, der relaterer mol opløst stof med det samlede volumen af opløsningen i liter.
Der er også molalitet eller også kaldet molal koncentration, der refererer til mol opløst stof, men som er indeholdt i en standardiseret mængde af opløsningsmidlet eller opløsningsmidlet, der er nøjagtigt et kg.
Dette opløsningsmiddel kan være rent, eller hvis opløsningen indeholder mere end et opløsningsmiddel, vil molaliteten være mol opløst stof pr. Kg af opløsningsmiddelblandingen..
Og den tredje enhed af kemisk koncentration er normaliteten eller den normale koncentration af en opløsning, der udtrykker antallet af kemiske ækvivalenter af det opløste stof pr. Liter af opløsningen.
Enheden, hvor normalitet udtrykkes, er i ækvivalenter pr. Liter (Eq / L), og i medicin udtrykkes koncentrationen af elektrolytter i humant serum i milliekvivalenter pr. Liter (mEq / L).
Måder til at udtrykke koncentration

Koncentrationen af en opløsning kan betegnes på tre hovedmåder, selvom de selv har et stort udvalg af udtryk og enheder, der kan bruges til at udtrykke mål for denne værdi: kvalitativ beskrivelse, kvantitativ notation og klassificering i form af opløselighed.
Afhængigt af det sprog og den kontekst, du arbejder på, vælges en af de tre måder at udtrykke koncentrationen af en blanding på.
Kvalitativ beskrivelse
Anvendes hovedsageligt på uformelt og ikke-teknisk sprog, den kvalitative beskrivelse af koncentrationen af en blanding udtrykkes i form af adjektiver, der på en generaliseret måde angiver det koncentrationsniveau, som en løsning har.
På denne måde er minimumskoncentrationsniveauet ifølge den kvalitative beskrivelse niveauet for en "fortyndet" opløsning, og det maksimale er niveauet for "koncentreret"..
Vi taler om fortyndede løsninger, når en opløsning har en meget lav andel af opløst stof som en funktion af det samlede volumen af opløsningen. Hvis du vil fortynde en opløsning, skal du tilføje mere opløsningsmiddel eller finde en måde at reducere opløsningen på.
Nu taler vi om koncentrerede løsninger, når de har en høj andel af opløst stof som en funktion af det samlede volumen af opløsning. For at koncentrere en opløsning skal du tilføje mere opløst stof eller reducere mængden af opløsningsmiddel.
I denne forstand kaldes denne klassificering en kvalitativ beskrivelse, ikke kun fordi den mangler matematiske målinger, men også på grund af dens empiriske kvalitet (den kan tilskrives visuelle træk, lugte og smag uden behov for videnskabelige tests)..
Klassificering efter opløselighed
Opløseligheden af en koncentration angiver den maksimale opløselighedskapacitet, som en opløsning har, afhængigt af betingelser såsom temperatur, tryk og de stoffer, der er opløst eller i suspension..
Opløsninger kan klassificeres i tre typer efter deres niveau af opløst opløst stof på måletidspunktet: umættede, mættede og overmættede opløsninger.
- Umættede opløsninger er dem, der indeholder mindre opløst stof, end opløsningen kan opløses. I dette tilfælde har opløsningen ikke nået sin maksimale koncentration.
- Mættede opløsninger er dem, hvor den maksimale mængde opløst stof er opløst i opløsningsmidlet ved en bestemt temperatur. I dette tilfælde er der en ligevægt mellem begge stoffer, og opløsningen kan ikke acceptere mere opløst stof (da det vil udfældes).
- Overmættede opløsninger har mere opløst stof, end opløsningen accepterer under ligevægtsbetingelser. Dette opnås ved opvarmning af en mættet opløsning, tilsætning af mere opløst stof end normalt. Når det er koldt, udfældes det ikke opløst stof automatisk, men enhver forstyrrelse kan forårsage denne effekt på grund af dets ustabilitet..
Kvantitativ notation
Når man studerer en opløsning, der skal anvendes inden for det tekniske eller videnskabelige område, kræves en præcision målt og udtrykt i enheder, der beskriver koncentrationen i henhold til dens nøjagtige værdier for masse og / eller volumen..
Derfor er der en række enheder, der bruges til at udtrykke koncentrationen af en opløsning i dens kvantitative notation, der er opdelt i fysiske og kemiske, og som igen har deres egne underinddelinger.
Enhederne med fysiske koncentrationer er enheder med "relativ koncentration", som udtrykkes i procent. Der er tre måder at udtrykke procentkoncentrationer på: masseprocent, volumenprocent og massevolumenprocent..
I stedet er enheder af kemiske koncentrationer baseret på molære mængder, gramækvivalenter, dele pr. Million og andre egenskaber ved det opløste stof i forhold til opløsningen..
Disse enheder er de mest almindelige på grund af deres høje præcision ved måling af koncentrationer, og af denne grund er de normalt dem, som du vil vide for at arbejde med kemiske løsninger..
Koncentrationsenheder
Som beskrevet i de foregående afsnit skal beregningerne styres af de eksisterende enheder til dette formål, når man kvantitativt karakteriserer koncentrationen af en opløsning..
Ligeledes er koncentrationsenhederne opdelt i enheder med relativ koncentration, enheder med fortyndede koncentrationer, enheder baseret på mol og andre yderligere..
Relative koncentrationsenheder
Relative koncentrationer er de udtrykt i procent som nævnt i det foregående afsnit. Disse enheder er opdelt i masse-masseprocent, volumen-volumenprocent og massevolumenprocent og beregnes som følger:
- % masse = masse af opløst stof (g) / masse af total opløsning (g) x 100
- % volumen = volumen opløst stof (ml) / volumen total opløsning (ml) x 100
- % masse / volumen = masse af opløst stof (g) / volumen af total opløsning (ml) x 100
For at beregne massen eller volumenet af den samlede opløsning skal massen eller volumenet af det opløste stof tilsættes sammen med opløsningsmidlet..
Enheder med fortyndet koncentration
De fortyndede koncentrationsenheder er de, der bruges til at udtrykke de meget små koncentrationer, der findes i form af spor i en fortyndet opløsning; den mest almindelige anvendelse af disse enheder er at finde spor af en gas opløst i en anden, såsom stoffer, der forurener luften.
Disse enheder er angivet i form af dele pr. Million (ppm), dele pr. Milliard (ppb) og dele pr. Billioner (ppt) og udtrykkes som følger:
- ppm = 1 mg opløst stof / 1 L opløsning
- ppb = 1 μg opløst stof / 1 L opløsning
- ppt = 1 ng opløst stof / 1 L opløsning
I disse udtryk er mg lig med milligram (0,001 g), μg er lig med mikrogram (0,000001 g), og ng er lig med nanogram (0,000000001 g). Disse enheder kan også udtrykkes som en funktion af volumen / lydstyrke.
Koncentrationsenheder som funktion af mol
Koncentrationsenhederne baseret på mol er dem af molfraktionen, molprocenten, molariteten og molaliteten (de to sidstnævnte er bedre beskrevet i slutningen af artiklen).
Molfraktionen af et stof er fraktionen af alle dets sammensatte molekyler (eller atomer) som en funktion af de samlede molekyler eller atomer. Det beregnes som følger:
xTIL = antal mol stof A / samlet antal mol i opløsning
Denne procedure gentages for de andre stoffer i opløsning under hensyntagen til, at summen af XTIL + xB + xC ... skal være lig med en.
Molprocenten arbejdes på samme måde som XTIL, kun i procent:
Molprocent af A = XTIL x 100%
Det sidste afsnit vil diskutere molaritet og molalitet i detaljer..
Formalitet og normalitet
Endelig er der to enheder af koncentration, der i øjeblikket er i ubrugt: formalitet og normalitet..
Formaliteten af en opløsning repræsenterer antallet af vægt-formel-gram pr. Liter total opløsning. Det udtrykkes som:
F = nr. P.F.G / L opløsning
I dette udtryk er P.F.G lig med vægten af hvert atom af stoffet, udtrykt i gram.
I stedet repræsenterer normaliteten antallet af opløste ækvivalenter divideret med liter opløsning, som udtrykt nedenfor:
N = ækvivalente gram opløst stof / L opløsning
I dette udtryk kan de ækvivalente gram opløst stof beregnes med antallet af mol H+, Åh- eller andre metoder, afhængigt af typen af molekyle.
Molaritet
Molariteten eller molkoncentrationen af et opløst stof er den enhed med kemisk koncentration, der udtrykker eller relaterer molene af det opløste stof (n), der er indeholdt i en (1) liter (L) af opløsningen.
Molaritet er betegnet med stort bogstav M, og for at bestemme molen af det opløste stof (n) divideres opløsningsmidlets gram (g) med den opløste opløsnings molekylvægt (MW)..
Ligeledes opnås den opløste opløsnings molekylvægt fra summen af atomvægtene (PA) eller atommassen af de kemiske grundstoffer i betragtning af den andel, hvori de kombineres til dannelse af det opløste stof. Således har forskellige opløste stoffer deres egen PM (selvom dette ikke altid er tilfældet).
Disse definitioner er opsummeret i følgende formler, der bruges til at udføre de tilsvarende beregninger:
Molaritet: M = n (mol opløst stof) / V (liter opløsning)
Antal mol: n = g opløst stof / MW opløst stof
Øvelse 1
Beregn molariteten for en opløsning, der er fremstillet med 45 g Ca (OH)to opløst i 250 ml vand.
Den første ting at beregne er molekylvægten af Ca (OH)to (calciumhydroxid). Ifølge dets kemiske formel består forbindelsen af en calciumkation og to hydroxylanioner. Her er vægten af en elektron, der er mindre eller yderligere til arten, ubetydelig, så atomvægten tages:
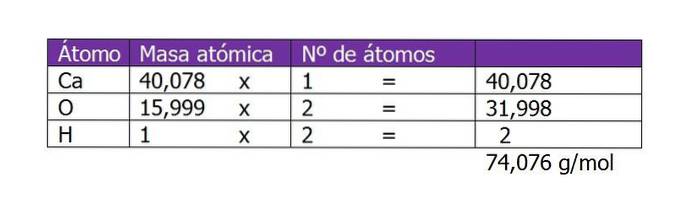
Antallet af mol af det opløste stof vil derefter være:
n = 45 g / (74 g / mol)
n = 0,61 mol Ca (OH)to
Der opnås 0,61 mol af det opløste stof, men det er vigtigt at huske, at disse mol ligger opløst i 250 ml opløsning. Da definitionen af molaritet er mol i en liter eller 1000 ml, skal der derefter foretages en simpel regel på tre til beregning af mol, der er i 1000 ml af opløsningen
Hvis der i 250 ml opløsning er => 0,61 mol opløst stof
I 1000 ml opløsning => x Hvor mange mol er der?
x = (0,61 mol) (1000 ml) / 250 ml
X = 2,44 M (mol / L)
Anden måde
Den anden måde at få mol til at anvende formlen kræver, at 250 ml tages til liter, idet der også anvendes en regel på tre:
Hvis 1000 ml => er 1 liter
250 ml => x Hvor mange liter er der?
x = (250 ml) (1 liter) / 1000 ml
x = 0,25 l
Erstatter derefter i molaritetsformlen:
M = (0,61 mol opløst stof) / (0,25 L opløsning)
M = 2,44 mol / l
Øvelse 2
Hvad betyder det for en HCl-opløsning at være 2,5 M.?
HCI-opløsningen er 2,5 molær, dvs. en liter af den har opløst 2,5 mol saltsyre..
Normal
Normaliteten eller ækvivalent koncentration er den enhed for den kemiske koncentration af de opløsninger, der er angivet med store bogstaver N. Denne koncentrationsenhed angiver opløsningsmiddelets reaktivitet og er lig med antallet af ækvivalenter opløst stof (ækvivalent) mellem opløsningens volumen udtrykt i liter.
N = Eq / L
Antallet af ækvivalenter (Eq) er lig med gram opløst stof divideret med den ækvivalente vægt (PEq).
Eq = g opløst stof / PEq
Den ækvivalente vægt eller også kendt som gramækvivalent beregnes ved at opnå den opløste opløsnings molekylvægt og dividere den med en ækvivalent faktor, der med henblik på opsummering i ligningen kaldes delta zeta (ΔZ).
PEq = PM / AZ
Beregning
Beregningen af normalitet vil have en meget specifik variation i den ækvivalente faktor eller AZ, som også afhænger af typen af kemisk reaktion, hvor den opløste eller reaktive art deltager. Nogle tilfælde af denne variation kan nævnes nedenfor:
-Når det kommer til en syre eller base, vil ΔZ eller den ækvivalente faktor være lig med antallet af hydrogenioner (H+) eller hydroxyl OH- der har det opløste stof. For eksempel svovlsyre (HtoSW4) har to ækvivalenter, fordi den har to sure protoner.
-Når det kommer til oxidationsreduktionsreaktioner, svarer AZ til antallet af elektroner, der er involveret i oxidations- eller reduktionsprocessen, afhængigt af det specifikke tilfælde. Det er her balance mellem kemiske ligninger og specifikationen af reaktionen kommer i spil..
-Ligeledes svarer denne ækvivalente faktor eller ΔZ til antallet af ioner, der udfældes i reaktioner klassificeret som udfældning..
Øvelse 1
Bestem normaliteten af 185 g NatoSW4 findes i 1,3 liter opløsning.
Molekylvægten af det opløste stof i denne opløsning beregnes først:
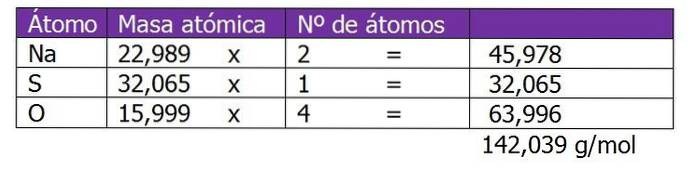
Det andet trin er at beregne den ækvivalente faktor eller ΔZ. I dette tilfælde, da natriumsulfat er et salt, vil valensen eller ladningen af kationen eller metalet Na blive overvejet.+, som ganges med 2, som er abonnementet på den kemiske formel salt eller opløst stof:
NatoSW4 => ∆Z = Valencia Kation x Abonnement
∆Z = 1 x 2
For at opnå den ækvivalente vægt erstattes den i sin respektive ligning:
PEq = (142,039 g / mol) / (2 ækv. / Mol)
PEq = 71,02 g / ækv
Og så kan du fortsætte med at beregne antallet af ækvivalenter og igen bruge en anden simpel beregning:
Eq = (185 g) / (71,02 g / Eq)
Antal ækvivalenter = 2.605 ækv
Endelig beregnes normaliteten med alle de nødvendige data nu ved at erstatte i henhold til dens definition:
N = 2,605 ækv. / 1,3 l
N = 2,0 N
Molalitet
Molalitet betegnes med små bogstaver m y er lig med mol opløst stof, der er til stede i et (1) kg af opløsningsmidlet. Det er også kendt som molal koncentration og beregnes ved hjælp af følgende formel:
m = mol opløst stof / kg opløsningsmiddel
Mens molaritet fastslår forholdet mellem mol opløst stof, der er indeholdt i en (1) liter opløsning, relaterer molaliteten mol opløst stof, der findes i et (1) kg opløsningsmiddel.
I de tilfælde, hvor opløsningen fremstilles med mere end et opløsningsmiddel, udtrykker molaliteten de samme mol opløst stof pr. Kg af opløsningsmiddelblandingen..
Øvelse 1
Bestem molaliteten af en opløsning, der blev fremstillet ved blanding af 150 g saccharose (C12H220elleve) med 300 g vand.
Molekylvægten af saccharose bestemmes først for at beregne mol opløst stof i denne opløsning:
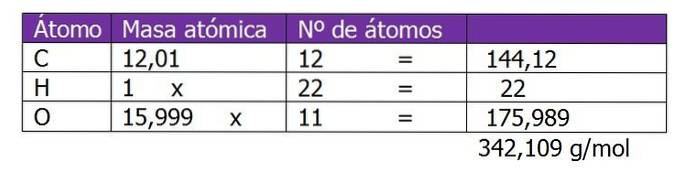
Antallet af mol saccharose beregnes:
n = (150 g saccharose) / (342,109 g / mol)
n = 0,438 mol saccharose
Derefter føres gram opløsningsmiddel til kilogram for at kunne anvende den endelige formel.
Udskifter derefter:
m = 0,438 mol saccharose / 0,3 kg vand
m = 1,46 mol C12H220elleve/ Kg HtoELLER
Selvom der i øjeblikket er en debat om det endelige udtryk for molalitet, kan dette resultat også udtrykkes som:
1,26 m C12H220elleve eller 1,26 molal
Det anses undertiden for fordelagtigt at udtrykke koncentrationen af opløsningen i form af molalitet, da masserne af det opløste stof og opløsningsmidlet ikke lider af små udsving eller uforudsete ændringer på grund af virkningerne af temperatur eller tryk; som det sker i opløsninger med gasformigt opløst stof.
Derudover påpeges det, at denne koncentrationsenhed henvist til en bestemt opløsningsmiddel er uændret ved eksistensen af andre opløste stoffer i opløsningen..
Anbefalinger og vigtige bemærkninger om kemisk koncentration
Opløsningsvolumenet er altid større end opløsningsmidlets volumen
Når løsningsøvelserne løses, opstår fejlen ved at fortolke en opløsnings volumen som om det var opløsningsmidlets. For eksempel, hvis et gram chokoladepulver opløses i en liter vand, er opløsningsvolumenet ikke lig med volumenet af en liter vand..
Hvorfor ikke? Fordi det opløste stof altid optager mellemrum mellem opløsningsmiddelmolekylerne. Når opløsningsmidlet har en høj affinitet for det opløste stof, kan volumenændringen efter opløsning være ubetydelig eller ubetydelig..
Men hvis ikke, og endnu mere, hvis mængden af opløst stof er stor, skal volumenændringen tages i betragtning. At være sådan: Vsolvent + Vsolute = Vsolution. Kun i fortyndede opløsninger, eller hvor mængden af opløst stof er lille, er gyldig Vsolvent = Vsolution.
Denne fejl skal huskes, især når man arbejder med flydende opløste stoffer. For eksempel, hvis honning opløses i alkohol i stedet for opløsning af pulveriseret chokolade, så vil volumenet af tilsat honning have signifikante virkninger på det samlede volumen af opløsningen..
Derfor skal volumenet af det opløste stof i disse tilfælde tilsættes opløsningsmidlets volumen..
Nyttighed af molaritet
-Kendskab til molariteten af en koncentreret opløsning gør det muligt at udføre fortyndingsberegninger ved hjælp af den enkle formel M1V1 = M2V2, hvor M1 svarer til den oprindelige molaritet af opløsningen og M2 Molariteten af opløsningen, der skal fremstilles ud fra opløsningen M1.
-Ved at kende en opløsnings molaritet kan dens normalitet let beregnes ved hjælp af følgende formel: Normalitet = antal ækvivalenter x M
Formlerne huskes ikke, men enhederne eller definitionerne er
Men nogle gange husker hukommelsen ikke alle ligningerne, der er relevante for koncentrationsberegninger. Til dette er det meget nyttigt at have en meget klar definition af hvert koncept.
Fra definitionen skrives enhederne ved hjælp af konverteringsfaktorer at udtrykke dem, der svarer til det, du vil bestemme.
For eksempel, hvis du har molalitet, og du vil konvertere den til normal, skal du gøre som følger:
(mol / kg opløsningsmiddel) x (kg / 1000 g) (g opløsningsmiddel / ml) (ml opløsningsmiddel / ml opløsning) (1000 ml / l) (ækv. / mol)
Bemærk, at (g opløsningsmiddel / ml) er densiteten af opløsningsmidlet. Udtrykket (ml opløsningsmiddel / ml opløsning) refererer til, hvor meget volumen af opløsningen faktisk svarer til opløsningsmidlet. I mange øvelser er denne sidste periode lig med 1 af praktiske årsager, selvom det aldrig er helt sandt..
Referencer
- Indledningskemi - 1St. Canadisk udgave. Kvantitative koncentrationsenheder. Kapitel 11 Løsninger. Hentet fra: opentextbc.ca
- Wikipedia. (2018). Ækvivalent koncentration. Hentet fra: en.wikipedia.org
- PharmaFactz. (2018). Hvad er molaritet? Hentet fra: pharmafactz.com
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 101-103, 512, 513.
- Vandige løsninger-molaritet. Hentet fra: chem.ucla.edu
- Quimicas.net (2018). Eksempler på normalitet. Gendannet fra: quimicas.net.


Endnu ingen kommentarer