
Dihydroxyacetonphosphat (DHAP) karakteristika og anvendelser
Det dihydroxyacetonphosphat Det er en kemisk forbindelse forkortet under akronymet DHAP. Det er en mellemmand i nogle metaboliske veje for levende organismer, såsom glykolytisk nedbrydning eller glykolyse, såvel som i Calvin-cyklusen i planter.
Biokemisk er DHAP produktet af et aldolaseenzyms virkning på fructose-1,6-bisphosphat (FBP), som forårsager en aldolytisk nedbrydning, hvilket resulterer i to tre-carbonforbindelser: DHAP og glyceraldehyd 3-phosphat (GAP).
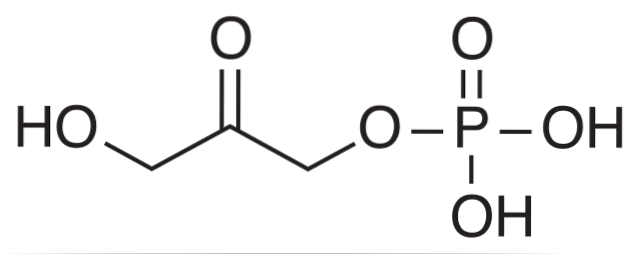
I Calvin-cyklussen udfører aldolase den omvendte reaktion og kondenserer DHAP-molekyler med GAP-molekyler til dannelse af en hexose..
Artikelindeks
- 1 Funktioner
- 2 DHAP i glykolyse
- 2.1 Aldolasereaktion
- 2.2 Reaktion af TIM
- 3 DHAP i Calvin-cyklussen
- 4 DHAP i glukoneogenese
- 5 Referencer
Egenskaber
DHAP er klassificeret inden for molekylerne kendt som ketotrioser. Disse er monosaccharider, der består af en kæde på tre carbonatomer (trioser) med carbonylgruppen på det centrale carbon (C2).
GAP og DAHP er funktionelle isomerer og udgør de enkleste kulhydrater inden for biologisk aktive organiske molekyler.
Selvom den kemiske struktur af mange almindelige kulhydrater såsom GAP og DHAP er aldehyder og ketoner, får de udtrykket kulhydrat, idet der henvises til direkte derivater af saccharider.
DHAP i glykolyse
I glykolyse nedbrydes en række reaktioner glukose til pyruvat. Denne nedbrydning forekommer gradvis i 10 på hinanden følgende trin, hvor forskellige enzymer griber ind, og der produceres en række mellemprodukter, som alle er phosphorylerede..
DHAP vises i glykolyse i den fjerde reaktion af denne proces, som består af nedbrydning af FBP i to kulhydrater af tre carbonatomer (trioser), hvoraf kun GAP fortsætter sekvensen af glykolyse, mens DHAP skal omdannes til GAP for at følge denne rute.
Denne reaktion katalyseres af en aldolase (fructose bisphosphate aldolase), som udfører en aldol-spaltning mellem C3- og C4-carbonatomer i FBP.
Denne reaktion finder kun sted, hvis den hexose, der skal opdeles, har en carbonylgruppe ved C2 og en hydroxyl ved C4. Af denne grund forekommer isomerisering af glucose-6-phosphat (G6P) til fructose-6-phosphat (F6P) tidligere..
DHAP er også involveret i den femte glykolysereaktion, idet den er isomerisering til GAP af enzymet triose phosphate isomerase eller TIM. Med denne reaktion er den første fase af glucose nedbrydning afsluttet..
Aldolase-reaktion
I aldol-nedbrydningen produceres to mellemprodukter, hvor DHAP udgør 90% af blandingen i ligevægt.
Der er to typer aldolaser: a) type I aldolase er til stede i dyre- og planteceller og er karakteriseret ved dannelsen af en Schiff-base mellem det enzymatiske aktive sted og carbonylet i FBP. b) Type II aldolase findes i nogle bakterier og svampe, den har et metal i det aktive sted (normalt Zn).
Aldolspaltningen begynder med vedhæftningen af substratet til det aktive sted og fjernelsen af en proton fra β-hydroxylgruppen, hvilket danner den protonerede Schiff-base (iminiumkation). Nedbrydningen af C3- og C4-carbonatomer frembringer frigivelsen af GAP og dannelsen af et mellemprodukt kaldet enamin..
Enaminen stabiliseres efterfølgende, så der dannes en iminiumkation, der hydrolyseres, hvormed DHAP endelig frigives, og det frie enzym regenereres således.
I celler med type II aldolase forekommer dannelsen af Schiff's base ikke, idet den er en divalent metallisk kation, generelt Znto+, den, der stabiliserer mellemproduktet enamin for at frigive DHAP.
TIM-reaktion
Som nævnt er ligevægtskoncentrationen af DHAP højere end GAP, således at DHAP-molekyler transformeres til GAP, da sidstnævnte anvendes i den følgende glykolysereaktion..
Denne transformation sker takket være TIM-enzymet. Dette er den femte reaktion af den glykolytiske nedbrydningsproces, og i den bliver C1- og C6-carbonatomer af glucose C3-carbonatomer i GAP, mens C2- og C5-carbonatomer bliver C2 og C3 og C4 af glucose, de bliver C1 af GAP.
TIM-enzymet betragtes som det "perfekte enzym", fordi diffusion styrer reaktionshastigheden, hvilket betyder, at produktet dannes lige så hurtigt som enzymets aktive sted og dets substrat kommer sammen..
I reaktionen af transformation af DHAP til GAP dannes et mellemprodukt kaldet enediol. Denne forbindelse er i stand til at opgive protonerne af hydroxylgrupperne til en rest af det aktive sted i TIM-enzymet..
DHAP i Calvin-cyklussen
Calvin-cyklussen er den fotosyntetiske reduktion af kulstof (PCR), der udgør den mørke fase af fotosyntese-processen i planter. I dette trin bruges produkterne (ATP og NADPH) opnået i procesens lette fase til at fremstille kulhydrater..
I denne cyklus dannes seks GAP-molekyler, hvoraf to omdannes til DHAP ved isomerisering takket være TIM-enzymets virkning i en omvendt reaktion på den, der sker i nedbrydningen af glykolyse. Denne reaktion er reversibel, selvom ligevægten i tilfælde af denne cyklus og i modsætning til glykolyse er forskudt mod konvertering af GAP til DHAP.
Disse DHAP-molekyler kan derefter følge to veje, den ene er en aldolkondensation katalyseret af en aldolase, hvor den kondenseres med et GAP-molekyle til dannelse af FBP.
Den anden reaktion, som en af DHAP'erne kan tage, er en phosphathydrolyse katalyseret af en sedoheptulose-bisphosphatase. I denne sidste rute reagerer det med en erythrose til dannelse af sedoheptulose 1,7-bisphosphat.
DHAP i glukoneogenese
Ved glukoneogenese omdannes nogle ikke-glukide forbindelser, såsom pyruvat, lactat og nogle aminosyrer til glucose. I denne proces vises DHAP igen gennem isomerisering af et GAP-molekyle ved hjælp af TIM, og derefter gennem en aldolkondensation bliver det FBP.
Referencer
- Bailey, P. S. og Bailey, C. A. (1998). Organisk kemi: begreber og anvendelser. Ed. Pearson Uddannelse.
- Devlin, T. M. (1992). Lærebog i biokemi: med kliniske sammenhænge. John Wiley & Sons, Inc..
- Garrett, R. H., & Grisham, C. M. (2008). Biokemi. Ed. Thomson Brooks / Cole.
- Nelson, D. L. og Cox, M. M. (2006). Lehninger Principles of Biochemistry 4. udgave. Ed Omega. Barcelona.
- Rawn, J. D. (1989). Biokemi (Nr. 577.1 RAW). Red. Interamericana-McGraw-Hill
- Voet, D. og Voet, J. G. (2006). Biokemi. Panamerican Medical Ed..
Endnu ingen kommentarer